-
晋代葛洪的《食肉方》(去除黑痣的药方)中记载:“取白炭灰(石灰)、获灰(草木灰)等分煎合……”可去黑痣。起到“食肉”作用的主要物质是( )
A.碳酸钙 B.熟石灰 C.烧碱 D.苛性钾
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.过量食用油脂会使人发胖,故应禁止摄入油脂
B.可用化工染色剂制作“彩色馒头”
C.用酒精浸泡捣烂的某些植物的花瓣制作酸碱指示剂
D.纯棉毛巾、塑料薄膜、尼龙绳属于有机合成材料
难度: 中等查看答案及解析
-
汽车尾气净化装置中,气体在催化剂作用下反应的示意图如下,相关说法不正确的是( )
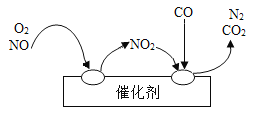
A.该装置有助于降低氮氧化合物的排放
B.大量排放反应最后的产物可引起温室效应
C.该装置可有效降低汽车尾气中的PM2.5的含量
D.尾气净化装置中发生总反应的化学方程式为2NO+O2+4CO
4CO2+N2
难度: 中等查看答案及解析
-
下列各组变化中,每一转化在一定条件下均能一步实现的是( )
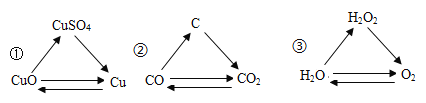
A.只有①②③ B.只有①② C.只有①③ D.②③
难度: 困难查看答案及解析
-
关于化学反应“甲+乙→丙+丁”的分析正确的是( )
A.若丙为气体,则甲、乙中一定有单质
B.若丙、丁为盐和水,则该反应一定是中和反应
C.若丁为水,则该反应一定是复分解反应
D.若丙为沉淀,则甲、乙中有一种物质可能是碱
难度: 困难查看答案及解析
-
下列所示的图象能反映相对应实验的是( )
A.
常温下向pH=10的NaOH溶液中不断加水稀释
B.
加热一定质量KMnO4粉末
C.
将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D.
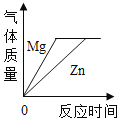 将等质量的金属镁片和锌片分别和足量的稀盐酸混合
将等质量的金属镁片和锌片分别和足量的稀盐酸混合难度: 中等查看答案及解析
-
如图所示,若先将滴管甲中的液体滴入烧杯甲中,观察到气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体滴入烧杯乙中,气球又明显鼓起,用下列各组物质进行试验能够观察到上述现象的是( )

选项
滴管甲
烧杯甲
滴管乙
烧杯乙
A
双氧水
二氧化锰
水
氢氧化钠固体
B
稀硝酸
碳酸氢钾
盐酸
氢氧化钠溶液
C
稀硫酸
铁
盐酸
碳酸钠
D
石灰水
稀盐酸
水
硝酸铵
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
氨气极易溶于水,可以还原氧化铜同时还生成水和一种无色气体单质M,该实验装置如下图所示,下列分析错误的是( )
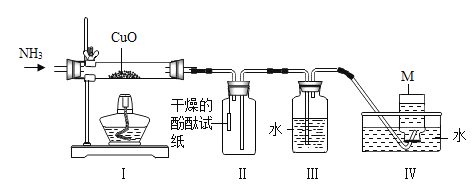
A.I中的固体逐渐变为红色
B.II中试纸会变成红色
C.装置IV收集的气体单质M可以在空气中燃烧
D.该实验能证明有水生成
难度: 中等查看答案及解析

