-
用铁泥(主要成分为Fe2O3、FeO和少量Fe)制备纳米Fe3O4,的流程示意图如下:
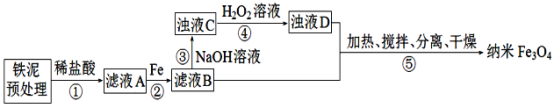
下列叙述错误的是
A. 为提高步骤①的反应速率,可采取搅拌、升温等措施
B. 步骤②中,主要反应的离子方程式是2Fe3++Fe=3Fe2+
C. 步骤④中,反应完成后剩余的H2O2无需除去
D. 步骤⑤中,“分离”包含的操作有过滤、洗涤
难度: 中等查看答案及解析
-
利用待测样品和指定的试剂设计实验能达到实验目的的是
实验目的
待测样品
试剂
A
检验补铁剂硫酸亚铁片是否部分氧化
硫酸亚铁片的水溶液
铁氰化钾溶液
B
检验洁厕剂的主要成分是盐酸
洁厕剂
硝酸银溶液
C
检验是否患糖尿病
患者尿液
硫酸铜溶液、纯碱溶液
D
检验海带中的碘元素
海带灰浸出液
氯水、淀粉溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某研究性小组为了探究石蜡油分解产物,设计了如下实验方案。下列说法错误的是
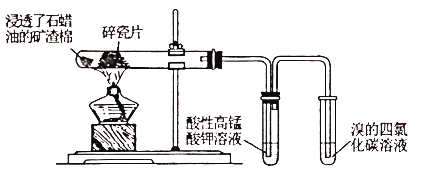
A. 石蜡油是石油减压蒸馏的产物
B. 碎瓷片加快了石蜡油的分解
C. 酸性高锰酸钾溶液褪色说明生成了乙烯
D. 溴的四氯化碳溶液褪色是因为发生了加成反应
难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,44.8 L CHCl3中含有氯原子的数目为6NA
B. 1mol葡萄糖(C6H12O6)分子含有的羟基数目为5NA
C. 7gLi在空气中完全燃烧转移的电子数为2NA
D. 0.5 mol/L NH4NO3溶液中含有的NH4+数目小于0.5NA
难度: 中等查看答案及解析
-
环之间共用一个碳原子的化合物称为螺环化合物。1,4-二氧杂螺[2.2]丙烷的结构简式为
。下列说法正确的是
A. 1mol该有机物完全燃烧需要4molO2
B. 该有机物与 HCOOCH=CH2互为同分异构体
C. 该有机物的二氯代物有3种
D. 该有机物所有原子均处于同一平面
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、Z位于同一主族。X的气态氢化物常用作制冷剂。ZYW2能与水剧烈反应,可观察到液面上有雾生成,并有刺激性气味的气体逸出,该气体可使品红溶液褪色。下列说法正确的是
A. 最简单氢化物的沸点:Z>Y
B. 原子半径:W>Z>Y>X
C. 把ZY2通入石蕊试液中先变红后褪色
D. 向ZYW2与水反应后的溶液中滴加AgNO3溶液有白色沉淀生成
难度: 中等查看答案及解析
-
常温下,向10mL0.1 mol/L CuCl2溶液中滴加0.1 mol/L Na2S溶液滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法错误的是
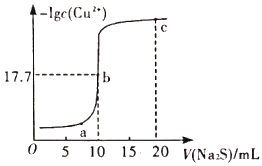
A. Ksp(CuS)的数量级为10-35
B. 曲线上各点的溶液均满足关系式c(S2-)·c(Cu2+)=Ksp(CuS)
C. a、b、c三点中,由水电离的c(H+)和c(OH-)的积最小的为b点
D. c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
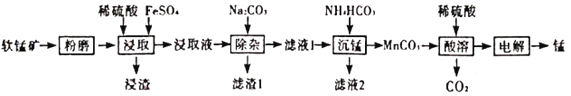

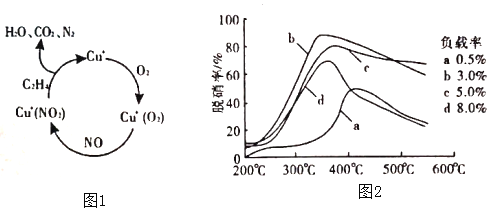

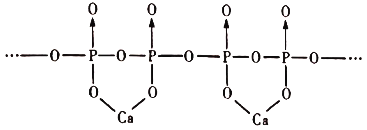
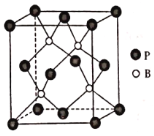
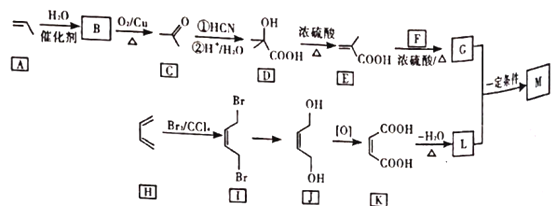
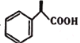 的合成路线___________(无机试剂任选)。
的合成路线___________(无机试剂任选)。