-
下列说法正确的是
A. 在海轮外壳上镶嵌锌块,会减缓船体的锈蚀
B. 某温度下向含AgCl固体的AgCl饱和溶液中加少量稀盐酸,AgCl的Ksp增大
C. 某雨水样品采集后放置一段时间,pH由4.68变为4.28,主要是溶液中的SO32-发生水解
D. 关于钢铁电化学保护中,外加电流的阴极保护法利用的是原电池原理
难度: 中等查看答案及解析
-
下列说法正确的是
A. 1molH2与0.5molO2反应放出的热量就是H2的燃烧热
B. 已知含20.0 g NaOH的稀溶液与稀盐酸完全中和,放岀28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH( aq)+CH3COOH( ag)= CH3 COONa(ag)+H2O(1)△H=-57.4 kJ·mol-1
C. 已知2C(s)+2O2=(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
D. 使用氢气作燃料有助于控制温室效应
难度: 中等查看答案及解析
-
下列说法正确的是
A. 加入合适的催化剂能降低反应活化能,从而改变反应的焓变
B. 在恒容密闭容器中发生N2(g)+3H2(g)
2NH3(g)△H<0,达到平衡后升高温度可提高N2转化率
C. 某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)
Z(g)+W(s)△H>0,当容器中气体压强不变时,该反应达到平衡状态
D. 对于可逆反应A(g)
B(g)+C(g),增大压强,正反应速率和逆反应速率都增大,并且正反应速率增大的程度大于逆反应速率增大的程度
难度: 中等查看答案及解析
-
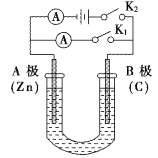
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是

A. 该装置中电子的流动方向为:铜电极→锌电极
B. 电池工作一段时间后,甲池溶液的总质量不变
C. 电池工作一段时间后,乙池的c(SO42-)不变
D. 溶液中阳离子通过交换膜从负极区向正极区移动保持溶液中电荷平衡
难度: 中等查看答案及解析
-
下列实验合理的是
A. 用湿润的pH试纸测定NaOH溶液的pH
B. 用已知浓度的烧碱溶液滴定未知浓度的盐酸,锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的盐酸
C. 用25mL的碱式滴定管量取20.00 mLKMnO4溶液
D. 中和反应反应热的测定实验中,读取混合溶液不再变化的温度记为终止温度
难度: 中等查看答案及解析
-
某温度下,向pH=6的蒸馏水中加入NaHSO4固体,保持温度不变,测得溶液pH为1。对于该溶液,下列叙述不正确的是
A. 该温度高于25℃
B. 由水电离出来的c(H+)=1×10-13mol/L
C. c(H+)+c(Na+)=c(OH-)+2c(SO42-)
D. 该温度下加入等体积pH为11的KOH溶液,可使反应后的溶液恰好呈中性
难度: 中等查看答案及解析
-
在密闭容器中,反应X(g)+2Y(g)
Z(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(X)=0.100mol·L-1,c(Y)=0.200mol·L-1,c(Z)=0mol·L-1。反应物X的浓度随时间的变化如图所示。下列说法正确的是
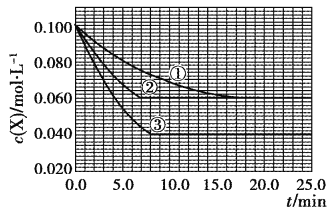
A. 实验②的温度高于实验①的温度
B. 实验②平衡时Y的转化率为60%
C. 实验③与实验①相比,实验③使用了催化剂
D. 反应X(g)+2Y(g)
Z(g)的△H>0
难度: 困难查看答案及解析