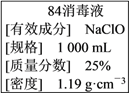-
下列溶液中,溶质的物质的量浓度不是1mol/L的是
A. 10gNaOH固体溶解在水中配成250mL溶液
B. 将80gSO3溶于水并配成1L的溶液
C. 将0.5mol/L的NaNO3溶液100mL加热蒸发掉50g水得到的溶液(假设无晶体析出)
D. 标况下,将22.4L氯化氢气体溶于水配成1L溶液
难度: 中等查看答案及解析
-
下列溶液中,跟100 mL 0.5 mol·L-1NaCl溶液所含的Cl-的物质的量浓度相同的是( )
A. 100 mL 0.5 mol·L-1MgCl2溶液
B. 200 mL 0.25 mol·L-1CaCl2溶液
C. 50 mL 1 mol·L-1NaCl溶液
D. 200 mL 0.25 mol·L-1HCl溶液
难度: 中等查看答案及解析
-
配制物质的量浓度为0.1 mol·L-1的Na2CO3溶液100 mL时,下列操作正确的是( )
A. 用托盘天平称取1.06 g无水碳酸钠,在烧杯中加适量水溶解,待冷却到室温后,将溶液转移到容量瓶中
B. 在使用容量瓶前必须检查容量瓶是否完好以及瓶塞处是否漏水
C. 定容时,若加水超过刻度线,可用胶头滴管小心吸出多余部分
D. 定容时,若仰视,则所配溶液的浓度将偏高
难度: 中等查看答案及解析
-
由硫酸钾、硫酸铝和硫酸组成的混合溶液,其c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c(SO
)=0.8 mol·L-1,则c(K+)为( )
A. 0.15 mol·L-1 B. 0.2 mol·L-1
C. 0.3 mol·L-1 D. 0.4 mol·L-1
难度: 简单查看答案及解析
-
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是( )
①w=
×100%
②c=
③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w
④若上述溶液中再加入0.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为c(NH4+)>c(Cl-)>c(OH-)>c(H+)
A. ①④ B. ②③ C. ①③ D. ②④
难度: 中等查看答案及解析
-
等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2的物质的量浓度分别为a mol/L和b mol/L。a与b的关系为 ( )
A. a=b B. a=2b C. 2a=b D. a=5b
难度: 中等查看答案及解析
-
钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法错误的是( )
A. 未知物质X为CO2,属于氧化产物
B. 每转移1 mol e-时,生成2 mol X
C. 反应中PdCl2作氧化剂,被还原
D. 还原性:CO>Pd
难度: 中等查看答案及解析
-
水热法制备纳米颗粒Y(化合物)的反应为3Fe2++2S2O
+O2+aOH-===Y+S4O
+2H2O,下列有关说法不正确的是( )
A. a=4
B. Y的化学式为Fe2O3
C. S2O
是还原剂
D. 每32 g O2参加反应,转移电子的物质的量为4 mol
难度: 中等查看答案及解析
-
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O
据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于ClO2的氧化性
D. 每1 mol ClO2生成,该反应转移的电子数约为6.02×1023
难度: 中等查看答案及解析
-
高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,化学方程式如下(未配平):
KMnO4+ FeSO4+ H2SO4= K2SO4+ MnSO4+ Fe2(SO4)3+ H2O
下列说法正确的是
A.MnO4-是氧化剂,Fe3+是还原产物
B.Fe2+的还原性强于Mn2+
C.取反应后的溶液加KSCN溶液,可观察到有血红色沉淀生成
D.生成1mol 水时,转移2.5mol电子
难度: 中等查看答案及解析
-
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:
H2O2→H2O IO3-→I2 MnO4-→Mn2+ HNO2→NO
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A. H2O2 B. IO3- C. MnO4- D. HNO2
难度: 中等查看答案及解析
-
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A. 硫元素被氧化
B. 氧化剂与还原剂的物质的量之比为1:2
C. 每生成1molNa2S2O3,转移4mol电子
D. 相同条件下,每吸收10m3SO2就会放出2.5m3CO2
难度: 困难查看答案及解析
-
有 Fe3+、Fe2+、NO3-、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是
A.还原产物为NH4+
B.氧化剂与还原剂的物质的量之比为1∶8
C.若有0.5mol NO3-参加还原反应,则转移电子8mol
D.若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+
难度: 中等查看答案及解析