-
化学与人类生产、生活密切相关,下列说法正确的是
A. 医用酒精、次氯酸钠等消毒液均可以将病毒氧化而达到消毒的目的
B. 铁粉和生石灰均可作食品袋内的脱氧剂
C. 纯银器表面在空气中逐渐变暗,是发生了化学腐蚀
D. 聚乙烯、聚氯乙烯塑料制品均可用于食品包装
难度: 简单查看答案及解析
-
晋代《抱扑子》中记载“丹砂(HgS)烧之成水银,积变又还成丹砂”。以上变化中没有涉及的反应类型是
A. 分解反应 B. 置换反应 C. 化合反应 D. 氧化还原反应
难度: 简单查看答案及解析
-
下列有关实验操作的说法中正确的是
A. 用CCl4萃取碘水中的碘单质,振荡过程中需进行放气操作
B. 用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度偏高
C. 用碱式滴定管量取25.00mL溴水
D. 用pH试纸测得氯水的pH为2
难度: 中等查看答案及解析
-
“三效催化转化器”可将汽车尾气中的有毒气体转化为无污染的气体,下图为该反应的微观示意图(末配平),其中不同符号的球代表不同种原子。下列说法不正确的是
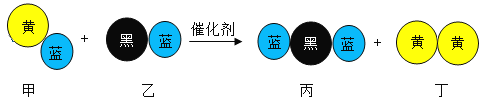
A. 该反应属于氧化还原反应
B. 配平后甲、乙、丙的化学计量数均为2
C. 甲和丙中同种元素化合价不可能相同
D. 丁物质一定是非金属单质
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 常温常压下,16gO2和O3混合气体中含有氧原子数为NA
B. 标准状况下,44.8三氯甲烷含有的分子数为2NA
C. 0.1mol·L-1氯化铝溶液中含有A13+数为0.1NA
D. 标准状况下,22.4LO2作氧化剂时转移电子数一定为4NA
难度: 中等查看答案及解析
-
下列有关离子检验的方法正确的是
A. 加入硝酸银溶液,产生白色沉淀,原溶液中一定含有C1-
B. 加入氢氧化钠溶液立即有白色沉淀产生,原溶液中一定含有A13+
C. 加入稀盐酸,产生能使澄清石灰水变浑浊的气体,原溶液中一定含有CO32-
D. 加入稀盐酸无现象,再加入氮化钡溶液有白色沉淀产生,原溶液中一定含有SO42-
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是
A. 加酚酞呈浅红色的溶液中:Ba2+、K+、HCO3-、NO3-
B. 由水电离出的c(H+)=1×10-13mol/L的溶液中:Ca2+、Na+、C1-、HS-
C. 加入铝粉能放出氢气的溶液中:Mg2+、Fe3+、Cl-、NO3-
D. 无色透明的溶液中:A13+、Cu2+、SiO32-、CH3COO-
难度: 中等查看答案及解析
-
氮化铝(AlN)是一种新型无机非金属材料,常温下可与烧碱溶液发生反应:AlN+NaOH+3H2O=NaAl(OH)4+NH3↑。某课题小组利用甲图所示装置测定样品中AlN的含量(杂质不反应,量气管为碱式滴定管改造)。下列说法正确的是
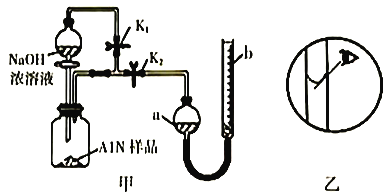
A. 量气管中的液体应为水
B. 用长颈漏斗代替分液漏斗,有利于控制反应速率
C. 反应结束时,a、b两管液面的差值即为产生气体的体积
D. 若其它操作均正确,实验结束时按乙图读数,测得AlN含量偏高
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
实验操作
现象
结论
A
将少量某酸(HA)溶液滴入碳酸钠溶液中
无气泡
酸性:H2CO3>HA
B
将浸透石蜡油的石棉和碎瓷片放入硬质玻璃管,加强热,将生成的气体通入酸性高锰酸钾溶液
高锰酸钾溶液褪色
石蜡油裂解生成不饱和烃
C
向蔗糖溶液中加入稀硫酸并水浴加热,一段时间后再向混合液中加入新制Cu(OH)2悬浊液并煮沸
无砖红色沉淀
蔗糖未水解
D
在1mL相同浓度的碳酸钠和硫酸钠溶液中,分别滴加2滴0.1mo1/L AgNO3溶液
碳酸钠溶液中出现沉淀
Ksp(Ag2SO4)<
Ksp (Ag2CO3)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列实验装置能达到实验目的的是
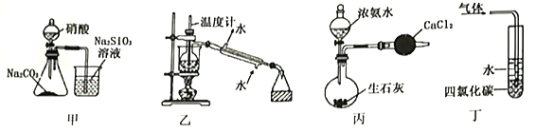
A. 用甲装置比较碳、氮和硅三种元素的非金属性强弱
B. 用乙装置分离碘的四氯化碳溶液
C. 用丙装置制取干燥的氨气
D. 用丁装置吸收氨气,并防止倒吸
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A. 苯与溴水可发生加成反应
B. 完全燃烧时,等质量的甲烷比乙烷耗氧量大
C. 糖类、油脂和蛋白质都可水解
D. 实验式为CH2O的有机物一定属于糖类
难度: 中等查看答案及解析
-
工业生产苯乙烯是利用乙苯的脱氢反应:
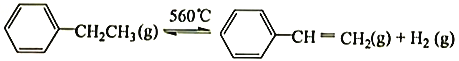
下列说法不正确的是
A. 该反应的逆反应属于还原反应
B. 苯乙烯和乙苯都至少有7个碳原子共面
C. 乙苯的一氯代物有3种
D. 煤的干馏可以得到苯和乙苯
难度: 中等查看答案及解析
-
下列对三种有机物的叙述不正确的是
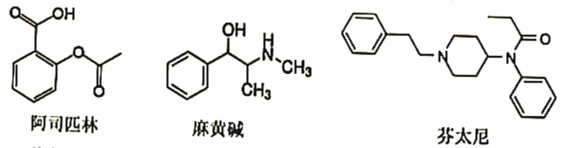
A. 三种有机物都是芳香族化合物
B. 阿司匹林在酸中水解生成2种含羧基的物质
C. 麻黄碱的分子式是C10H13NO
D. 芬太尼可发生取代、加成、氧化反应
难度: 中等查看答案及解析
-
现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且每个甲、乙、丙分子中均含10个电子,Y和Z化合生成丁,有关物质的转化关系如下图所示。下列说法错误的是

A. 原子序数由小到大的顺序是:W<Z<Y<X
B. Z的最高价氧化物对应的水化物一定为强酸
C. 化合物的沸点由高到低的顺序是:乙>甲>丙
D. Y与W、Z都能形成两种或两种以上的化合物
难度: 中等查看答案及解析
-
利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:
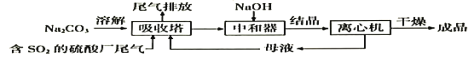
下列说法错误的是
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-=SO32-+H2O
C. 进入离心机的分散系是悬浊液
D. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 将SO2气体通入NaC1O溶液中:SO2+2C1O-+H2O=SO32-+2HC1O
B. 向明矾溶液中滴加Na2S溶液:2A13++3S2-=A12S3↓
C. 向KHSO4溶液中加入Ba(OH)2溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
D. NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3·H2O
难度: 中等查看答案及解析
-
在一密闭的容器中充入2molA和1molB发生反应:2A(g)+B(g)
xC(g),达到平衡后,C的体积分数为w%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mo1充入容器,达到平衡后,C的体积分数仍为w%,则x的值为
A. 2 B. 3 C. 2或3 D. 无法确定
难度: 中等查看答案及解析
-
已知:N2O4(g)
2NO2(g) △H=+QkJ/mol (Q>0),80℃时在2L密闭容器中充入0.40 mol N2O4,发生反应获得如下数据:
时间/s
0
20
40
60
80
100
c(NO2)/mol/L
0.00
0.12
0.20
0.26
0.30
0.30
下列判断正确的是
A. 升高温度会使混合气体的颜色变浅
B. 反应达平衡时,吸收的热量为0.30Q kJ
C. 20~40s内,v(N2O4)=0.004mol/(L·s)
D. 100s时再充入0.40mo1N2O4,达到新平衡时N2O4的转化率增大
难度: 中等查看答案及解析
-
某课题组以纳米Fe2O3作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。下列说法正确的是

A. 放电时,正极的电极反应式为 Fe2O3+6Li++ 6e-=2Fe+3Li2O
B. 该电池可以用水溶液做电解质溶液
C. 放电时,Fe作电池的负极,Fe2O3作电池的正极
D. 充电完成后,电池被磁铁吸引
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
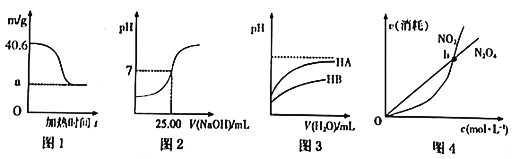
A. 若图1表示0.2mo1MgCl2·6H2O在空气中充分加热时固体质量随时间的变化,则a为19.0
B. 若图2表示常温下用0.1000mo1/L NaOH溶液滴定25.00mL CH3COOH溶液的滴定曲线,则c(CH3COOH)=0.1000mo1/L
C. 若图3表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
D. 若图4表示恒温恒容条件下,反应2NO2(g)
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,则b点对应的状态为化学平衡状态
难度: 中等查看答案及解析
-
下图是某元素的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,各物质转化关系如图所示。下列说法正确的是
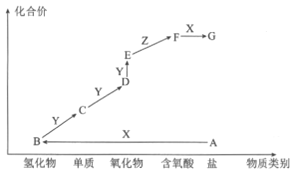
A. A是可与草木灰混合使用的肥料 B. C可用排空气法收集
C. F和B能发生复分解反应生成盐 D. B在一定条件下可直接与Y反应生成D
难度: 中等查看答案及解析
-
常温下,用0.1000mol/L的AgNO3溶液滴定50.00mL0.0500mol/LKC1溶液,以K2CrO4为指示剂,测得溶液中pCl=-1gc(C1-)、pAg=-1gc(Ag+)随加入AgNO3溶液的体积变化如图所示。已知:Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,溶液中离子浓度小于或等于1.0×10-5mol/L则沉淀完全,下列说法错误的是

A. Ag2CrO4沉淀一定不是白色
B. AgC1的溶度积常数Ksp数量级为10-10
C. Cl-恰好完全沉淀时,指示剂的浓度应维持在2.0×10-2mol/L
D. 加入50 mLAgNO3溶液后再加入1mL0.01mol/LH2SO4会产生新的沉淀
难度: 困难查看答案及解析


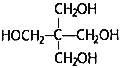 )的路线___________(无机试剂任选)
)的路线___________(无机试剂任选)