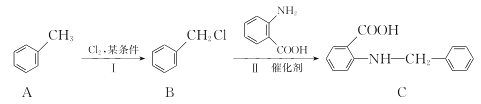
-
化学对社会发展与进步产生着巨大的贡献。德国化学家哈伯(F.Haber)的重要贡献是( )
A. 实验证实了夸克的存在
B. 发现了黄绿色气体氯气
C. 开发了合成氨的生产工艺
D. 提出了蛋白质分子的螺旋结构模型
难度: 中等查看答案及解析
-
下列过程属于化学变化的是( )
A. 过滤 B. 分液
C. 裂化 D. 蒸馏
难度: 中等查看答案及解析
-
人工放射性核素
在核医学领域中有重要的用途。该原子的中子数是( )
A. 53 B. 78
C. 131 D. 184
难度: 中等查看答案及解析
-
工业上制取高纯度硅的反应之一为SiCl4+2H2
Si+4HCl。该反应属于( )
A. 化合反应 B. 分解反应
C. 置换反应 D. 复分解反应
难度: 中等查看答案及解析
-
下列化学用语表示正确的是( )
A. 葡萄糖的分子式:C12H22O11
B. CaCl2的电子式:
C. F-的结构示意图:
D. 氯化铵的电离方程式:NH4Cl===NH3+HCl
难度: 中等查看答案及解析
-
下列气体可用如图所示方法干燥的是( )

A. CO2 B. Cl2
C. NH3 D. SO2
难度: 中等查看答案及解析
-
下列物质属于共价化合物的是( )
A. H2 B. Na2O
C. CH4 D. KOH
难度: 中等查看答案及解析
-
下列关于反应2SO2+O2
2SO3说法不正确的是( )
A. 升高温度能加快反应速率
B. 使用催化剂能加快反应速率
C. 增大O2浓度能加快反应速率
D. 反应中SO2和SO3的物质的量之和变小
难度: 中等查看答案及解析
-
下列物质的俗名与化学式对应正确的是( )
A. 苏打——Na2CO3 B. 冰晶石——CaF2
C. 石膏——MgSO4 D. 水玻璃——SiO2
难度: 中等查看答案及解析
-
在含有大量H+、Fe3+、SO42-的溶液中,还可能大量共存的离子是( )
A. NO3- B. Ba2+
C. CO32- D. AlO2-
难度: 中等查看答案及解析
-
尿素[CO(NH2)]2是一种氮肥,它属于( )
A. 酸 B. 碱
C. 盐 D. 有机物
难度: 简单查看答案及解析
-
下列关于碳酸钠的说法正确的是( )
A. 受热易分解 B. 水溶液呈碱性
C. 不与碱反应 D. 具有漂白性
难度: 中等查看答案及解析
-
下列装置能达到实验目的的是( )
A. 收集氨气
 B. 测氯水pH
B. 测氯水pH
C. 除去氯气中的氯化氢
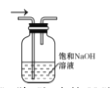 D. 蒸发氯化钠溶液
D. 蒸发氯化钠溶液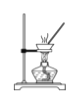
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 乙醇属于烃类化合物 B. 苯能发生取代反应
C. 乙酸能发生银镜反应 D. 纤维素遇碘水变蓝
难度: 中等查看答案及解析
-
关于反应4Fe(OH)2+O2+2H2O===4Fe(OH)3,下列说法正确的是( )
A. O2发生还原反应 B. Fe(OH)2被还原
C. H2O发生氧化反应 D. H2O是氧化剂
难度: 中等查看答案及解析
-
下列溶液不能与Ba(OH)2反应的是( )
A. 氯化钠溶液 B. 硫酸铜溶液
C. 硝酸铁溶液 D. 氯化铵溶液
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 醋酸溶液与氢氧化钠溶液反应:H++OH-===H2O
B. 碳酸钙跟盐酸反应:CO32-+2H+===CO2↑+H2O
C. 铜与稀硝酸反应:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
D. 铁与氯化铁溶液反应:2Fe+Fe3+===3Fe2+
难度: 中等查看答案及解析
-
下列反应吸收热量的是( )
A. 氧化钙与水反应 B. 焦炭制水煤气
C. 酸碱中和反应 D. 钠与水反应
难度: 中等查看答案及解析
-
下列实验方案能达到目的的是( )
A. 用品红溶液检验SO2
B. 用焰色反应鉴别KNO3和KCl
C. 用澄清石灰水鉴别MgCl2溶液和NaHCO3溶液
D. 用丁达尔效应区分FeCl3溶液和Fe2(SO4)3溶液
难度: 中等查看答案及解析
-
某原电池装置如图所示,下列说法正确的是( )
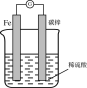
A. Fe作正极
B. 碳棒上有O2生成
C. 可将电能转化为化学能
D. 电子从Fe经导线流向碳棒
难度: 中等查看答案及解析
-
下列有机反应属于加成反应的是( )
A. 2CH3CH2OH+O2
2CH3CHO+2H2O
B. CH2==CH2+Br2―→CH2BrCH2Br
C. CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
D. CH4+Cl2
CH3Cl+HCl
难度: 中等查看答案及解析
-
X、Y、Z、Q、W是原子序数依次增大的短周期主族元素,X的原子序数等于其电子层数,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,元素Q的单质可被用作输电的导线,W单质在常温下呈气态。下列说法正确的是( )
A. 金属性:Q>Z
B. 原子半径:W>Q>Z
C. 化合物XW与ZW含有相同类型的化学键
D. 元素Z、Q的最高价氧化物对应的水化物能发生反应
难度: 困难查看答案及解析
-
向200 mL 2.0 mol·L-1的稀硝酸中加入一定量的铜粉和铁粉,若反应只产生NO气体,则下列说法不正确的是( )
A. 若铁粉有剩余,则加入铁粉的质量可能为8.5 g
B. 若铜粉有剩余,则反应后的溶液中加入硫酸,铜会继续溶解
C. 若铁粉和铜粉完全溶解,铁粉和铜粉总的物质的量为a mol,则a≤0.15
D. 若向所得溶液中逐滴加入NaOH溶液,当沉淀量最多时消耗0.4 mol NaOH
难度: 困难查看答案及解析

 。
。