-
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水的颜色呈浅绿色,说明氯水中含有Cl2
B. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D. 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是( )
A. 强碱性溶液中:K+、Al3+、Cl-、SO42—
B. 在无色透明的溶液中:K+、Cu2+、NO3—、SO42—
C. 含有0.1 mol·L−1 Ca2+的溶液中:Na+、K+、CO32—、Cl-
D. 室温下,pH=1的溶液中:Na+、Fe3+、NO3—、SO42—
难度: 简单查看答案及解析
-
下列关于煤、石油、天然气等资源的说法正确的是
A. 煤的气化和液化过程只发生物理变化
B. 天然气作为化工原料,主要用于合成氨和生产甲醇
C. 石油分馏的目的是生产乙烯、丙烯、甲烷等化工原料
D. 天然气和液化石油气的主要成分是甲烷
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A. 硝基苯的结构简式:
B. 乙烯的比例模型:
C. 过氧化氢的电子式:
D. 硫离子的结构示意图:
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列叙述正确的是
A.1.0 L 1.0 mol•L﹣1 的NaAlO2水溶液中含有的氧原子数为2 NA
B.常温下,0.l mol碳酸钠晶体中含有CO32- 的个数为0.1
C.标准状况下,11.2L 18O2中所含中子数为8NA
D.25℃时,l L pH=13的Ba(OH)2溶液中含有的OH- 数为0.2
难度: 困难查看答案及解析
-
反应X(g)+Y(g)
2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
A. 减小容器体积,平衡向右移动
B. 加入催化剂,Z的产率增大
C. 增大c(X),X的转化率增大
D. 降低温度,Y的转化率增大
难度: 简单查看答案及解析
-
下列应用与水解原理无关的是( )
A. 实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
B. 泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将二者混合就可产生大量二氧化碳的泡沫
C. 用氯化铵溶液除去铁锈
D. 可用碳酸钠与醋酸制取少量二氧化碳
难度: 中等查看答案及解析
-
下列物质反应后,固体质量减轻的是
A.水蒸气通过灼热的铁粉
B.二氧化碳通过Na2O2粉末
C.将Zn片放入CuSO4溶液
D.铝与MnO2发生铝热反应
难度: 中等查看答案及解析
-
由2氯丙烷制取少量的1,2丙二醇时,需要经过下列哪几步反应 ( )
A. 加成→消去→取代 B. 消去→加成→水解
C. 取代→消去→加成 D. 消去→加成→消去
难度: 中等查看答案及解析
-
某有机物X的结构简式如图所示,则下列有关说法中正确的是
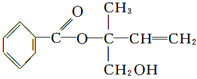
A. X的分子式为C12H16O3
B. 可用酸性高锰酸钾溶液区分苯和X
C. X在一定条件下能发生加成、加聚、取代、消去等反应
D. 在Ni作催化剂的条件下,1 mol X最多只能与1 mol H2加成
难度: 中等查看答案及解析
-
有机物M的结构简式是
 ,能用该结构简式表示的M的同分异构体共有(不考虑立体异构)( )
,能用该结构简式表示的M的同分异构体共有(不考虑立体异构)( )A. 12种 B. 16种 C. 20种 D. 24种
难度: 简单查看答案及解析
-
X、Y、M、N是短周期主族元素,且原子序数依次增大.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y原子在短周期主族元素中原子半径最大,下列说法正确的是( )
A. M与X形成的化合物对应的水化物一定是强酸
B. Y2X和Y2X2中阴、阳离子的个数比相同,化学键类型也完全相同
C. X、Y的简单离子半径:r(X2﹣)>r(Y+)
D. M的气态氢化物比X的气态氢化物稳定
难度: 中等查看答案及解析
-
下列说法正确的是( )
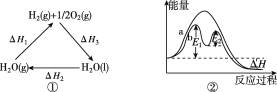
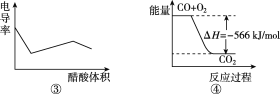
A. 图①中ΔH1=ΔH2+ΔH3
B. 图②在催化剂条件下,反应的活化能等于E1+E2
C. 图③表示醋酸溶液滴定 NaOH溶液和氨水混合溶液的电导率变化曲线
D. 图④可表示由CO(g)生成CO2(g)的过程中要放出566 kJ 热量
难度: 困难查看答案及解析
-
一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3[Fe(CN)6]和亚铁氰化钾K4[Fe(CN)6]的混合溶液,下列说法不正确的是( )
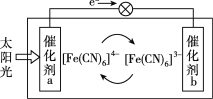
A. K+移向催化剂b
B. 催化剂a表面发生的化学反应:[Fe(CN)6]4--e-===[Fe(CN)6]3-
C. [Fe(CN)6]3-在催化剂b表面被氧化
D. 电解质溶液中的[Fe(CN)6]4-和[Fe(CN)6]3-浓度基本保持不变
难度: 简单查看答案及解析
-
常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知Ksp(CaSO4)=9×10-6。下列说法不正确的是( )
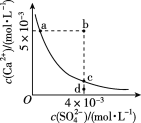
A. a点对应的Ksp等于c点对应的Ksp
B. 加入Na2SO4溶液可以使a点变为b点
C. b点将有沉淀生成
D. d点未达到沉淀溶解平衡状态
难度: 中等查看答案及解析
-
在常温下,用0.1000 mol/L的盐酸滴定25 mL 0.1000 mol/L Na2CO3溶液,所得滴定曲线如下图所示。下列有关滴定过程中溶液相关微粒浓度间的关系不正确的是
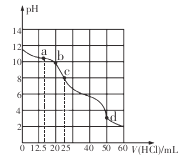
A. a点:c( HCO3-)>c(Cl-)>c(C032-)
B. b点:c(Na+)+c(H+)=c(Cl一)+c(HCO3-)+c(CO32-)+c(OH-)
C. c点:c(OH-)+c(CO32-)=c(H+)+c(H2CO3)
D. d点:c(Cl-)=c(Na+)
难度: 困难查看答案及解析
-
在500mLKNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5mol
B. 向电解后的溶液中加入98g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4mol/L
D. 电解后溶液中c(H+)=2mol/L
难度: 困难查看答案及解析
-
下列实验“操作和现象”与“结论”对应且正确的是( )
选项
操作和现象
结论
A
将少量溴水加入KI溶液中,充分反应后再加入CCl4,振荡,静置,下层液体呈紫色
氧化性:Br2>I2
B
常温下,打磨后的铝片放入浓HNO3中,无明显反应现象
常温下,铝不与浓HNO3反应
C
向一定量AgNO3溶液中,先滴加几滴KCl溶液,再滴加几滴KI溶液,先出现白色沉淀,后出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
D
用pH计测定NaF溶液和CH3COONa溶液:pH(NaF)<pH(CH3COONa)
酸性:HF>CH3COOH
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
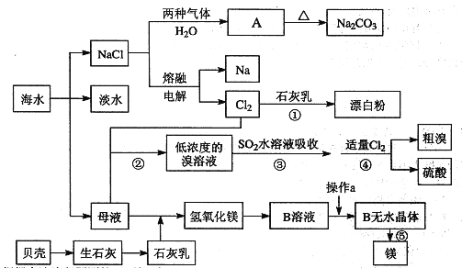
铝土矿的主要成分为Al2O3和SiO2(含有少量不溶性杂质),利用铝土矿制备Al(OH)3流程如下(所用化学试剂均过量)。
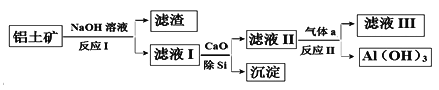
下列说法不正确的是
A. Al(OH)3可用作治疗胃酸过多
B. 加CaO除Si得到的沉淀主要成分为H2SiO3
C. 气体a成分为CO2
D. 滤液III中溶质为Ca(HCO3)2和NaHCO3
难度: 中等查看答案及解析
-
室温时,将xmL pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应.下列关于反应后溶液pH的判断,正确的是( )
A. 若x=y,且a+b=14,则pH>7 B. 若10x=y,且a+b=13,则pH=7
C. 若ax=by,且a+b=13,则pH=7 D. 若x=10y,且a+b=14,则pH>7
难度: 中等查看答案及解析
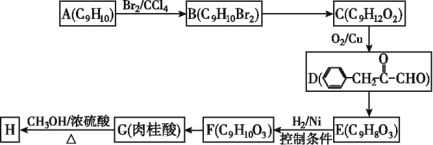
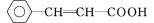 ),继而合成H的路线如下:
),继而合成H的路线如下: