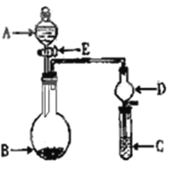
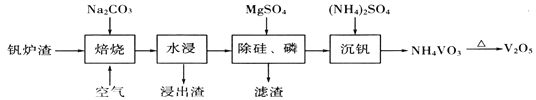
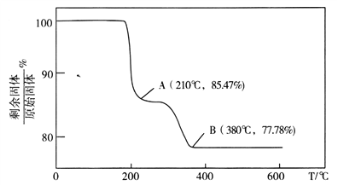
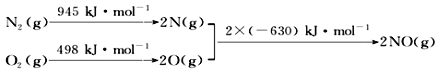-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 56 g Fe 与1mol Cl2充分反应,转移的电子数目为3NA
B. 1L 0.1mol/L Na2CO3溶液中含有的CO32-和HCO3-的总数为0.1NA
C. 25℃时,1L pH=12的Ba(OH)2溶液中含有的OH-的数目为0.02NA
D. 常温常压下,22 gD3O+中含有10NA 个电子
难度: 中等查看答案及解析
-
下列事实与胶体性质无关的是( )
A. 在豆浆里加盐卤做豆腐
B. 盐碱地里土壤保肥能力差
C. 一束平行光照到蛋白质溶液里时,从侧面可以看到一束光束
D. 三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀
难度: 简单查看答案及解析
-
化学与生产、生活、社会密切相关,下列说法正确的是
A. 漂白粉长期放置在空气中会被空气中的氧气氧化而变质
B. 二氧化硫可用作葡萄酒的食品添加剂
C. 通讯领域中的光导纤维可长期浸泡在强碱性溶液中
D. 汽车尾气中含有的氮氧化物是汽油不完全燃烧生成的
难度: 简单查看答案及解析
-
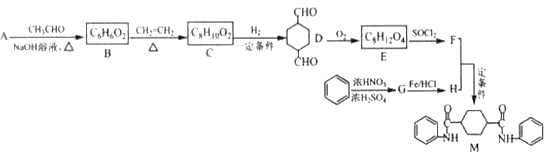
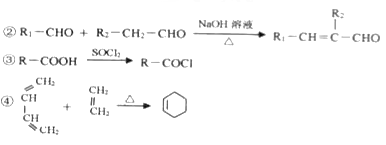
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种,下列说法正确的是
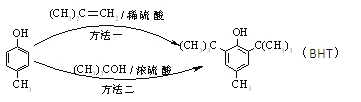
A.
与BHT互为同系物
B.
属于芳香烃
C. BHT能与NaHCO3溶液反应生成CO2
D. 两种方法的反应类型都是加成反应
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、U原子序数依次增大。X与W位于同一主族,Y、Z形成的氧化物均是常见的耐火材料,W原子的最外层电子数是次外层电子数的一半,Z、W、U原子的最外层电子数之和为13。下列说法正确的是
A. X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X
B. Y、Z元素的单质作电极,在氢氧化钠溶液中构成原电池,Z电极上产生大量气泡
C. 室温下,0.05mol·L-1U的气态氢化物的水溶液的pH>1
D. Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U
难度: 中等查看答案及解析
-
目前海水液化可采用双极膜电液析法、同时获得副产品,其模拟工作原理如图所示。其中双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。M、N 为离子交换膜。下列说法正确的是
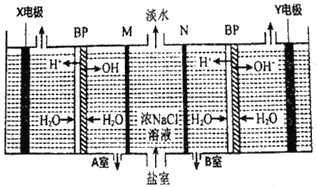
A. X 电极为电解池的阴极,该电极反应式为: 2H+-2e-=H2↑
B. 电子流向: 电源负极→X电极→Y 电极→电源正极
C. 电路中每转移1mol 电子,X、Y两极共得到标准状况下16.8L的气体
D. M为阳离子交换膜,A室获得副产品NaOH; 若去掉B室双极膜,B室产物不变
难度: 中等查看答案及解析
-
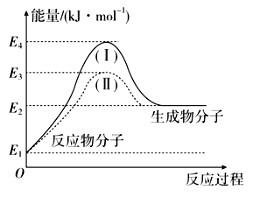
某温度时,向10mL.0.1mol/LCaCl2溶液中滴加0.1mol/L的Na2CO3溶液。滴加过程中溶液中-1gc(Ca2+)与Na2CO3溶液体积(V)的关系如图所示,下列有关说法正确的是( )
(已知1g5=0.7)
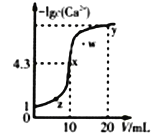
A. x、y两点c(Ca2+)之比为2000:3 B. Ksp(CaCO3)=5×10-9
C. w点对应的分散系很稳定 D. x、y、z三点中,水的电离程度最大的为x点
难度: 简单查看答案及解析