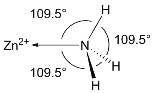
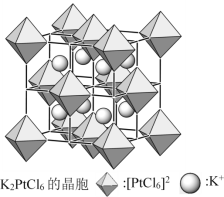
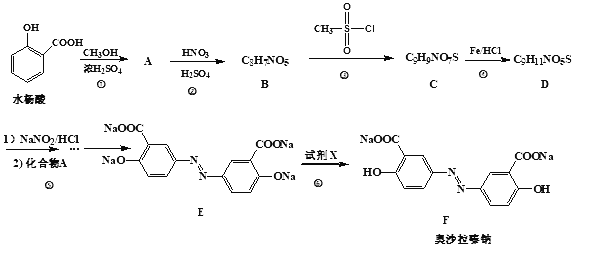
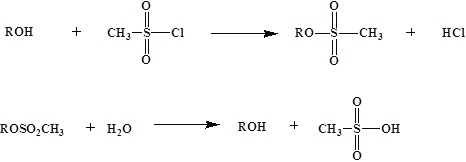
-
下列说法错误的是
A. 地沟油经过分离提纯后可制成生物柴油
B. 常用投加明矾、硫酸铁等电解质的方法处理浑浊的水
C. 汽车尾气中的氮氧化合物主要源自汽油中含氮化合物与氧气反应的产物
D. 废弃电池回收利用,既可以减少环境污染,又可以节约资源
难度: 中等查看答案及解析
-
下列有关离子检验的操作和实验结论都正确的是
选项
实验操作及现象
实验结论
A
向某溶液中加入NaOH稀溶液,用湿润的红色石蕊试纸靠近试管口检验,试纸不变蓝
原溶液中一定不含有NH4+
B
向某溶液中加入足量的盐酸无明显现象,再加入BaCl2溶液,产生白色沉淀
原溶液中一定含有SO42-
C
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体
原溶液中一定含有CO32-
D
用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色
原溶液中不含K+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 2.8g乙烯和丙烯的混合气体中含有0.4NA个共用电子对
B. 2.24L甲烷气体中含有0.4NA个C-H键
C. 1mL 0.1mol/LFeCl3溶液滴入沸水中可生成含有1.0×10-4NA个Fe(OH)3胶粒的胶体
D. 78g过氧化钠中含有NA个阴离子
难度: 中等查看答案及解析
-
某有机物分子式为C5H10O3,与饱和NaHCO3溶液反应放出气体体积与同等状况下与Na反应放出气体体积相等,该有机物有(不含立体异构)
A. 9种 B. 10种 C. 11种 D. 12种
难度: 中等查看答案及解析
-
化学可以变废为宝,利用电解法处理烟道气中的NO,将其转化为NH4NO3的原理如下图所示,下列说法错误的是
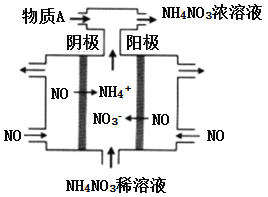
A. 该电解池的阳极反应为:NO - 3e- + 2H2O = NO3- + 4H+
B. 为使电解产物全部转化为NH4NO3,需补充物质A为HNO3
C. 该电解池的电极材料为多孔石墨,目的是提高NO的利用率和加快反应速率
D. 用NH4NO3的稀溶液代替水可以增强导电能力,有利于电解的顺利进行
难度: 中等查看答案及解析
-
五种短周期元素的某些性质如下表所示,有关说法正确的是
元素
元素的相关信息
M
最高正价与最低负价的绝对值之和等于2
W
原子的M电子层上有3个电子
X
在短周期元素中,其原子半径最大
Y
最外层电子数是电子层数的2倍,且低价氧化物能与其气态氢化物反应生成Y的单质和H2O
Z
最高价氧化物的水化物与气态氢化物反应生成盐
A. W、Y、Z的简单离子半径依次增大
B. M与Y、Z分别形成的化合物属于只含有极性键的共价化合物
C. W与M、Y分别形成的化合物都能与水反应,且有气体生成
D. 常温下,X、Y、Z的最高价氧化物对应水化物的浓溶液都能与单质W持续反应
难度: 中等查看答案及解析
-
常温下,下列有关溶液中微粒的物质的量浓度关系错误的是
A. pH为5的NaHSO3溶液中:c(HSO3-)>c(H2SO3)>c(SO32-)
B. 向NH4Cl溶液中加入NaOH固体至pH=7,所得溶液中:c(Cl-)>c(NH4+)>c(Na+)=c(NH3·H2O)>c(OH-)=c(H+)
C. 将等体积、等物质的量浓度的CH3COONH4与NaCl溶液混合:c(CH3COO-)+c(Na+) = c(Cl-) + c(NH4+)
D. 20mL 0.1mol/L NH4HSO4溶液与30mL0.1mol/L NaOH溶液混合,(pH>7):c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
难度: 困难查看答案及解析