-
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个反应:SO2+2Fe3++2H2O == SO42-+4H++2Fe2+,Cr2O72-+6Fe2++14H+ == 2Cr3++6Fe3++7H2O。下列说法正确的是( )
A. Cr2O72-不能将SO2氧化 B. 还原性:Cr3+>Fe2+>SO2
C. 氧化性:Cr2O72->Fe3+>SO2 D. 两个反应中Fe3+均表现还原性
难度: 中等查看答案及解析
-
Cu2O是赤铜矿的主要成分,Cu2S是辉铜矿的主要成分。铜的冶炼过程通常发生反应:Cu2S+2Cu2O===6Cu+SO2↑,下列有关说法正确的是
A. 该反应中有三种元素的化合价发生了变化
B. 每生成0.1 mol Cu,转移0.2 mol 电子
C. Cu2S在反应中既是氧化剂又是还原剂
D. Cu既是氧化产物又是还原产物
难度: 简单查看答案及解析
-
下列说法正确的是
A. 氨气的水溶液能导电,所以氨气是电解质
B. 1 mol·L-1的硫酸钠溶液与1 mol·L-1的氢氧化钠溶液导电性不同
C. 氢氧化铁胶体能导电,故氢氧化铁胶体是电解质
D. 在相同条件下,饱和溶液一定比不饱和溶液的导电性强
难度: 简单查看答案及解析
-
下列事故处理方法正确的是( )
A. 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
B. 制取并用排水法收集氧气结束后,应立即停止加热
C. 浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D. 浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤
难度: 中等查看答案及解析
-
焰火“脚印”、“笑脸”、“五环”,让北京奥运会开幕式更加辉煌、浪漫,这与高中化学中“焰色反应”知识相关。下列说法中正确的是: ( )
A. 焰色反应是化学变化
B. 用稀盐酸清洗做焰色反应的铂丝(镍丝或铁丝)
C. 焰色反应均应透过蓝色钴玻璃观察
D. 利用焰色反应可区分NaC1与Na2CO3固体
难度: 简单查看答案及解析
-
下列有关胶体的说法不正确的是( )
A. 分散系中分散质粒子的大小:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
B. FeCl3溶液和Fe(OH)3胶体都能透过滤纸
C. 当一束强可见光通过Fe(OH)3胶体时会出现光亮的“通路”
D. 将饱和FeCl3溶液滴入NaOH溶液中可制得Fe(OH)3胶体
难度: 简单查看答案及解析
-
实验需要配制KMnO4溶液,下列操作会引起所配溶液浓度偏大的是( )
A. 容量瓶用蒸馏水洗涤后未干燥即用来配制溶液
B. 定容时,观察液面俯视刻度线
C. 摇匀后,液面低于刻度线,没有再加蒸馏水
D. 用蒸馏水洗涤烧杯和玻璃棒,并将洗涤液转移入容量瓶中
难度: 简单查看答案及解析
-
下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法正确的一组是( )
序号
物质
杂质
除杂质应选用的试剂或操作方法
①
KNO3溶液
KOH
加入FeCl3溶液,并过滤
②
FeSO4溶液
CuSO4
加入过量铁粉,并过滤
③
H2
CO2
通过盛有NaOH溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶
④
NaNO3
CaCO3
溶解、过滤、蒸发
A. ①②③④ B. ③④ C. ②③④ D. ①②③
难度: 简单查看答案及解析
-
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;继续加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为( )
A. Na2CO3、Al(OH)3 B. AgCl、NaHCO3
C. NaHCO3、BaCO3 D. Na2SiO3、CuO
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述不正确的是
A.标准状况下,6.72L O2和N2的混合气体含有的原子数为0.6NA
B.通常状况下,8g O2和O3 的混合气体含有的分子数是0.5NA
C.常温常压下, 2mol/L的100mL MgCl2溶液中,含有Cl- 个数为0.4NA
D.标准状况下,11.2L H2在氧气中完全燃烧后得到的产物的分子数为0.5NA
难度: 中等查看答案及解析
-
一个集气瓶的质量为20.0g,在相同状况下,装满O2时质量为21.0g,装满A气体时为22.0g,则A气体的摩尔质量为 ( )
A. 16g/mol B. 32g/mol C. 64g/mol D. 128g/mol
难度: 中等查看答案及解析
-
在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1 mol•L﹣1,SO42-的物质的量浓度为0.3 mol•L﹣1,则混合液中K+的物质的量浓度为( )
A. 0.15 mol•L﹣1 B. 0.45 mol•L﹣1
C. 0.3 mol•L﹣1 D. 0.6 mol•L﹣1
难度: 简单查看答案及解析
-
下列判断合理的是( )
①硫酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物
②能电离出金属离子和酸根离子的化合物都是盐
③金属氧化物一定是碱性氧化物
④根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子的转移,将化学反应分为氧化还原反应和非氧化还原反应
A. 只有②④ B. 只有③④ C. 只有①③⑤ D. 只有①②⑤
难度: 简单查看答案及解析
-
下列溶液中,所给离子一定能大量共存的是( )
A. 含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
B. 使酚酞变红的溶液:Na+、Ca2+、SO42-、CO32-
C. 含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D. 含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
难度: 简单查看答案及解析
-
对下列实验现象及其解释不正确的是
A. 金属钠在Cl2中燃烧产生白烟,这是因为产生的NaCl固体颗粒分散到空气中所致
B. 把烧红的铁丝放在氧气中,发出耀眼白光,产生黑色固体,这是因为该反应放热多,生成的Fe3O4为黑色
C. 单质Mg、Al与O2反应,条件不同,可能产生不同的产物
D. 镁带在空气中点燃发出耀眼光芒,并发生三个反应:2Mg+O2
2MgO、3Mg+N2
Mg3N2、2Mg+CO2
2MgO+C(黑色),Mg常用于照明弹。在这些反应中,Mg都是作还原剂
难度: 中等查看答案及解析
-
某化学兴趣小组在实验室中探究Ti、Mg、Cu的活泼性顺序。他们在相同温度下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,现象如下:
金属
Ti
Mg
Cu
金属表面现象
放出气泡速度缓慢
放出气泡速度快
无变化
下列有关三种金属的说法中正确的是( )
A. 三种金属的活泼性由强到弱的顺序是Ti、Mg、Cu
B. 若钛粉中混有Mg,提纯Ti时可用稀盐酸除去Mg
C. 用Ti从CuSO4溶液中置换出Cu是工业制取Cu的很好途径
D. Cu和MgCl2溶液不发生化学反应
难度: 简单查看答案及解析
-
实验室测定铁矿石中的含硫量是将矿石在氧气流中灼烧,使硫转化为SO2,再转化为H2SO4,然后用NaOH溶液中和测定。在氧气流中灼烧0.4 g含硫铁矿石,使其中的硫元素先转化为SO2,再转化为H2SO4,用20 mL 0.5 mol·L-1的NaOH溶液恰好完全中和这些H2SO4,则该矿石中硫元素的质量分数为( )
A. 30% B. 40% C. 53.3% D. 36.4%
难度: 简单查看答案及解析
-
某溶液中可能含有大量的Mg2+、Al3+、H+、Cl-和少量OH-,向该溶液中逐滴加入0.5 mol·L-1NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积之间的关系如下图所示,则可判断原溶液中( )

A. 有Mg2+,没有Al3+
B. 有Al3+,没有Mg2+
C. 有Mg2+和Al3+
D. 有大量的H+、Mg2+和Al3+
难度: 中等查看答案及解析
-
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是( )
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
难度: 中等查看答案及解析
-
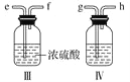
纯二氧化硅可用下列流程制得。下列说法不正确的是

A.X可用作木材防火剂
B.步骤II的反应是Na2SiO3 + H2SO4 = H2SiO3(胶体) + Na2SO4
C.步骤Ⅱ中的稀硫酸可用CO2来代替
D.步骤 Ⅲ若在实验室完成,一般在蒸发皿中进行
难度: 困难查看答案及解析
-
某同学用右图所示的装置及药品进行酸性强弱比较的实验,下列说法不正确的是
A.①和②中发生的反应均为复分解反应
B.向Na2SiO3饱和溶液中滴酚酞溶液无明显现象
C.一段时间后②中有胶冻状物质生成
D.该实验能证明酸性强弱的顺序是:硫酸>碳酸>硅酸
难度: 中等查看答案及解析
-
取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
难度: 中等查看答案及解析
-
如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
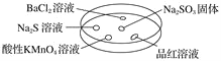
下表中对实验现象的描述或所做的解释不正确的是( )
选项
实验现象
解释
A
BaCl2溶液变浑浊
SO2与BaCl2溶液反应产生了BaSO3沉淀
B
Na2S溶液变浑浊
SO2与Na2S溶液反应产生了S单质
C
酸性KMnO4溶液褪色
SO2具有还原性
D
品红溶液褪色
SO2具有漂白性
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
随着我国汽车年销量的大幅增加,给空气环境造成了很大的污染。汽车尾气装置里,气体在催化剂表面吸附与解吸作用的过程如图所示,下列说法正确的是( )
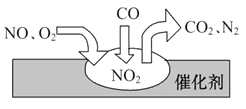
A. 反应中NO为氧化剂,N2为氧化产物
B. 汽车尾气的主要污染成分包括CO、NO和N2
C. NO和O2必须在催化剂表面才能反应
D. 催化转化总化学方程式为2NO+O2+4CO
4CO2+N2
难度: 困难查看答案及解析
-
下列实验操作或装置(略去部分夹持仪器)正确的是( )
A. 喷泉实验
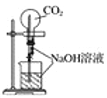 B. 配制一定物质的量浓度的NaCl溶液
B. 配制一定物质的量浓度的NaCl溶液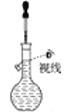
C. 排水法收集NO
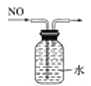 D. 碳酸氢钠受热分解
D. 碳酸氢钠受热分解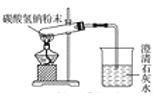
难度: 困难查看答案及解析