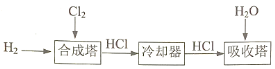
-
下列分子中的所有原子均在同一平面内的是( )
A. 甲烷 B. 乙烯 C. 乙酸 D. 甲苯
难度: 简单查看答案及解析
-
原子晶体具有的性质是( )
A. 熔点高 B. 易导热 C. 能导电 D. 有延展性
难度: 简单查看答案及解析
-
有关合金的说法正确的是( )
A. 生铁比纯铁熔点高 B. 钢比纯铁硬
C. 合金不具有导热性 D. 合金都不含非金属元素
难度: 简单查看答案及解析
-
实验室收集下列气体的方法肯定与NO2相同的是( )
A. NH3 B. O2 C. HCl D. CH2=CH2
难度: 简单查看答案及解析
-
在“HI(s)→HI(g)→H2和I2”的变化过程中,被破坏的作用力依次是( )
A. 范德华力、范德华力 B. 范德华力、共价键
C. 共价键、离子键 D. 共价键、共价键
难度: 中等查看答案及解析
-
下列反应可用:H++OH—→H2O表示的是( )
A. HNO3+Ba(OH)2 B. HCl+Fe(OH)3
C. NaHCO3+NaOH D. HF+NH3·H2O
难度: 中等查看答案及解析
-
同温同压下,80mL A2气体和240mL B2气体恰好完全反应,生成160mL X气体,X的分子式是( )
A. AB2 B. A2B C. AB3 D. A3B
难度: 中等查看答案及解析
-
通入SO2能引起下列溶液的颜色变化,其中SO2的作用和SO2使溴水褪色相同的是( )
A. 品红褪色 B. NaOH酚酞溶液褪色
C. 石蕊试液变红 D. 酸性KMnO4溶液褪色
难度: 简单查看答案及解析
-
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高。则下列溶液沸点最高的是( )
A. 0.01mol/L的蔗糖溶液 B. 0.01mol/L的MgCl2溶液
C. 0.02mol/L的H2S溶液 D. 0.02mol/L的NaNO3溶液
难度: 中等查看答案及解析
-
25℃时,CH3COONa溶液显碱性,是因为( )
A. CH3COO—电离出了OH— B. CH3COO—结合了水电离的H+
C. Na+和水反应生成了NaOH D. Na+促进了水的电离
难度: 简单查看答案及解析
-
对钢铁析氢腐蚀和吸氧腐蚀的比较,合理的是( )
A. 负极反应不同 B. 正极反应相同
C. 析氢腐蚀更普遍 D. 都是电化学腐蚀
难度: 简单查看答案及解析
-
由物理变化引起的颜色改变是( )
A. 光照使Cl2和CH4的混合气体变浅 B. 浓硫酸使蔗糖变黑
C. 溴水中加苯振荡使水层褪色 D. 通电使CuCl2溶液变浅
难度: 简单查看答案及解析
-
下列各组物质混合时,前者过量和不足时,发生不同化学反应的是( )
A. NaOH溶液和AlCl3溶液 B. 稀H2SO4与Al(OH)3
C. Al和NaOH溶液 D. 氨水与Al2(SO4)3溶液
难度: 中等查看答案及解析
-
用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入过量的铁粉,充分反应后,最终溶液中的金属阳离子( )
A. 只含Fe2+ B. 含Cu2+和Fe2+ C. 含Cu2+和Fe3+ D. 只含Fe3+
难度: 简单查看答案及解析
-
微信热传的“苯宝宝表情包”可看作是由苯衍生的物质配以相应文字形成的(如下图),苯不属于( )

A. 环烃 B. 芳香烃 C. 不饱和烃 D. 烃的衍生物
难度: 简单查看答案及解析
-
汽车尾气中的氮氧化合物(NOx)与大气中的NH3发生如下作用,形成一种雾霾。
NOx
N2O5
HNO3
烟(一种雾霾)
有关该雾霾的叙述错误的是( )
A. 该雾霾中含硝酸铵固体 B. 反应②是非氧化还原反应
C. NH3是形成该雾霾的催化剂 D. NH3可能来自过度施用氮肥
难度: 中等查看答案及解析
-
硫酸工业的有关叙述错误的是( )
A. 硫铁矿磨成粉末,可加快反应速率
B. 煅烧硫铁矿时鼓入较大量空气,可提高原料利用率
C. 接触室(发生反应:2SO2+O2
2SO3)使用热交换器,可充分利用能量
D. 接触室出来的气体被浓硫酸(SO3溶于其中)吸收后,可直接排放到空气中
难度: 简单查看答案及解析
-
某制碱厂的生产流程示意图如下:
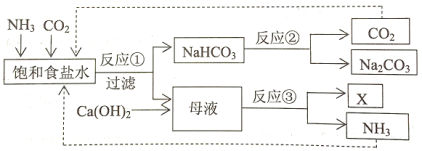
下列分析正确的是( )
A. 该制碱法是侯氏制碱法 B. 反应①中包含复分解反应
C. X中只含有Ca2+和Cl— D. 理论上,生产过程中无需补充CO2
难度: 中等查看答案及解析
-
某溶液中可能含有Na+、NH4+、I-、S2-、Cl-。分别取样:①测得溶液显弱酸性;②滴加氯水和淀粉至过量,始终无明显现象。为确定该溶液的组成,必须的检验方法或试剂是( )
A. 焰色反应 B. NaOH溶液(加热) C. HNO3酸化AgNO3溶液 D. SO2气体
难度: 中等查看答案及解析



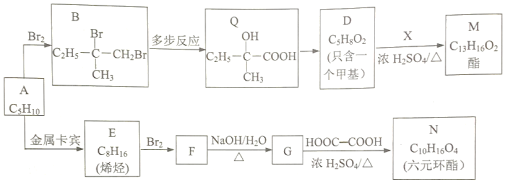
 )
)