-
工业上通过电解精制饱和食盐水来制备NaOH、H2、Cl2,再合成盐酸。完成下列填空:
(1)粗盐提纯:为除去粗盐中的Ca2+、Mg2+、SO42—。向粗盐溶液中依次加入稍过量的NaOH溶液、______,过滤后,再向滤液中加入适量__________,再蒸发。
(2)电解饱和食盐水:25℃,电解10L饱和食盐水,若阴极收集到标准状况下11.2L_______(填气体化学式),则溶液pH=_______(设溶液体积、温度不变、忽略生成物间的反应)。
(3)工业制盐酸:利用Cl2和H2化合,所得产物再溶于水的方法制得盐酸,生产流程如下:

为确保Cl2完全反应,合成塔中n(H2)略大于n(Cl2)。写出一条Cl2必须反应完全的理由:______。
(4)盐酸浓度测定:可用滴定法,用盐酸滴定已知质量Na2CO3的溶液。过程如下:准确称量一定质量的Na2CO3固体于锥形瓶中,加蒸馏水使其溶解,滴加指示剂X,用待测盐酸滴定,接近终点时,加热锥形瓶,煮沸液体2min,冷却至室温,继续滴定至终点,记录消耗盐酸的体积。重复上述过程三次,计算盐酸浓度。
已知:指示剂X的变色范围是5.0~5.2; 25℃,饱和CO2水溶液pH≈4。
①本测定用的仪器有锥形瓶、烧杯、玻璃棒、____________________________________。
②本测定的反应原理是________________________________(用化学方程式表示)。
③接近终点时煮沸反应混合物的目的是_______________________________。
④盛放Na2CO3固体的锥形瓶不干燥,对实验结果的影响是_________(填“偏大”、“偏小”或“无影响”)。
-
工业上通过电解精制饱和食盐水来制备NaOH、H2、Cl2,再合成盐酸。完成下列填空:
(1)粗盐提纯:为除去粗盐中的Ca2+、Mg2+、SO42—。向粗盐溶液中依次加入稍过量的NaOH溶液、______,过滤后,再向滤液中加入适量__________,再蒸发。
(2)电解饱和食盐水:25℃,电解10L饱和食盐水,若阴极收集到标准状况下11.2L_______(填气体化学式),则溶液pH=_______(设溶液体积、温度不变、忽略生成物间的反应)。
(3)工业制盐酸:利用Cl2和H2化合,所得产物再溶于水的方法制得盐酸,生产流程如下:
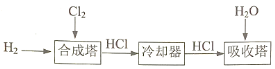
为确保Cl2完全反应,合成塔中n(H2)略大于n(Cl2)。写出一条Cl2必须反应完全的理由:______。
(4)盐酸浓度测定:可用滴定法,用盐酸滴定已知质量Na2CO3的溶液。过程如下:准确称量一定质量的Na2CO3固体于锥形瓶中,加蒸馏水使其溶解,滴加指示剂X,用待测盐酸滴定,接近终点时,加热锥形瓶,煮沸液体2min,冷却至室温,继续滴定至终点,记录消耗盐酸的体积。重复上述过程三次,计算盐酸浓度。
已知:指示剂X的变色范围是5.0~5.2; 25℃,饱和CO2水溶液pH≈4。
①本测定用的仪器有锥形瓶、烧杯、玻璃棒、____________________________________。
②本测定的反应原理是________________________________(用化学方程式表示)。
③接近终点时煮沸反应混合物的目的是_______________________________。
④盛放Na2CO3固体的锥形瓶不干燥,对实验结果的影响是_________(填“偏大”、“偏小”或“无影响”)。
-
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。完成下列填空:
(1)写出上述制备小苏打的化学方程式__________
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤 ②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是___________(选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是________________;滤渣的主要成分是________________。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。选甲基橙而不选酚酞作为指示剂的原因是_________。
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果__。(选填“偏高”、“偏低”或“无影响”)
-
在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
完成下列填空:
(1)写出上述制备小苏打的化学方程式。____________________
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是__________(选填编号)
a.①析出的氯化铵纯度更高 b.②析出的 氯化铵纯度更高
氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是____________________________。
滤渣的主要成分是_________________、_________________。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。
实验中所需的定量仪器除电子天平外,还有__________________。
样品中NaHCO3的质量分数为__________________。(保留1位小数)
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果______________。(选填“偏高”、“偏低”或“无影响”)
-
氯碱工业是以电解饱和食盐水为基础的基本化学工业。下图是某氯碱工业生产原理示意图:
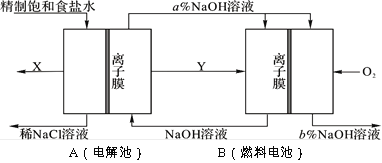
(1)A装置所用食盐水由粗盐水精制而成。精制时,为除去食盐水中的Mg2+和Ca2+,要加入的试剂分别为___________、___________。
(2)写出装置A在通电条件下反应的化学方程式______________。
(3)氯碱工业是高耗能产业,按上图将电解池与燃料电池相组合的新工艺可以节(电)能30%以上,且相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中Y是___(填化学式);X与稀NaOH溶液反应的离子方程式是:______________。
②分析比较图示中氢氧化钠质量分数a%与b%的大小___________。
③若用B装置作为A装置的辅助电源,每当消耗标准状况下氧气的体积为11.2 L时,则B装置可向A装置提供的电量约为______________(一个e-的电量为1.60×10-19C;计算结果精确到0.01)。
-
工业上电解饱和食盐能制取多种化工原料,如图是离子交换膜法电解饱和食盐水示意图,下列说法中不正确的是( )
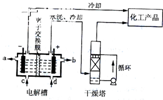
A.电解槽阳极的反应方程式为:2Cl--2e-═Cl2↑
B.产品 NaOH的出口是b
C.精制饱和食盐水的进口为d
D.干燥塔中应使用的液体是浓硫酸
-
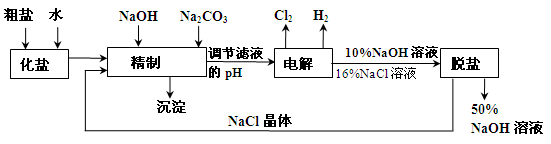
氯碱厂电解饱和食盐水溶液制取NaOH的工艺流程示意图如下:

依据上图,完成下列问题:
(1)写出电解饱和食盐水的离子方程式:________.
(2)粗盐常含Ca2+、Mg2+、SO42-等杂离子,精制过程中要将它们以沉淀的形式除去,则加入试剂的合理顺序为________(填编号).
A.先加入NaOH,后加入Na2CO3,再加入BaCl2溶液
B.先加入NaOH,后加入BaCl2溶液,再加入Na2CO3
C.先加入BaCl2溶液,后加入NaOH,再加入Na2CO3
(3)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________(填写操作名称)、冷却结晶、________(填写操作名称),除去NaCl.
(4)由图示可知在电解制碱过程中________可以循环使用,以提高反应物利用率;在制碱的同时,还产生H2和Cl2,工业上常常利用它们生产________.
(5)如图所示,目前电解法制烧碱通常采用离子交换膜法,阳离子交换膜不允许阴离子通过,阴离子交换膜不允许阳离子通过.则以下叙述正确的是________(填编号).
A.NaOH、H2均在Ⅰ区产生
B.图中a为阴离子交换膜,b为阳离子交换膜
C.Ⅲ区炭棒上的电极反应式为 2Cl--2e→Cl2↑
D.取少量Ⅲ区中的溶液,滴加酚酞,溶液变红色
(6)在实际生产中,经过脱盐后得到含溶质质量分数约为50%的NaOH溶液(密度为1.92g/cm3),则该烧碱溶液的物质的量浓度为________.

-
(14分)氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号)
a. Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
(6)写出电解饱和食盐水的离子方程式:
-
工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1) 右图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是 ; NaOH溶液的出口为______ (填字母);精制饱和食盐水的进口为_____ (填字母);干燥塔中使用的液体干燥剂是____(每空2分)。
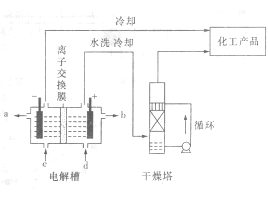
(2) 原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加人的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是 (2分)(填序号)。
(3) 多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为 ________(2分)。 也可转化为
也可转化为 而循环使用。一定条件下,在200C恒容密闭容器中发生反应:
而循环使用。一定条件下,在200C恒容密闭容器中发生反应: 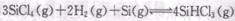 ,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。
,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。
(4)已知1 g阴极产生的气体在阳极产生的气体中完全燃烧时放出92. 3 kj的热量,则该反应的热化学方程式为: ________________(2分)。
-
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:

依据上图完成下列问题:
在电解过程中,阴极上生成气体的电子式为________。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为________。
(3)精制过程要除去 ,可选择下列溶液中的________(填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
,可选择下列溶液中的________(填字母序号),并将加入的顺序以箭头符号(↓)的形式画在图上(精制过程中加入试剂从左到右的顺序为先后顺序)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去 (已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:________。
(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释:________。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、________、(填操作名称)而制得50%的NaOH溶液。







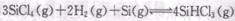 ,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。
,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。