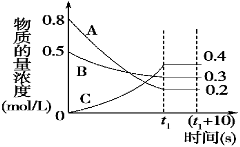
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·
L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.X、Y的转化率不相等
D.c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
难度: 中等查看答案及解析
-
在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应
A(s)+3B(g)
2C(g)+D(g)已达平衡状态的是
①混合气体的压强;②混合气体的密度;③B的物质的量浓度;④气体的总物质的量;⑤混合气体的平均相对分子质量
A.①②③ B.②③⑤ C.①③⑤ D.①④⑤
难度: 中等查看答案及解析
-
某温度时,一定压强下的密闭容器中发生反应:
aX(g)+bY(g)
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
A. 平衡正移 B. (a+b)>(c+d)
C. Z的体积分数变小 D. X的转化率变大
难度: 中等查看答案及解析
-
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容
器中SO2的转化率为p%,则乙容器中SO2的转化率
A、等于p% B、大于p% C、小于p% D、无法判断
难度: 困难查看答案及解析
-
在密闭容器中进行下列反应:M(g)+N(g)
R(g)+2L,此反应符合下面图像,下列叙述正确的是
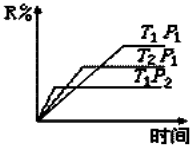
A.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
难度: 困难查看答案及解析
-
在一恒压密闭容器中充入1 mol NO2建立如下平衡:2 NO2
N2O4, 此时NO2的转化率为x%,在其他条件不变的条件下,再充入1 mol NO2,待新平衡建立时测得NO2的转化率为y%,则大小关系正确的是
A.x < y B.x = y
C.x > y D.无法确定
难度: 困难查看答案及解析
-
下列能正确表示氢气与氯气反应生成氯化氢过程中能量变化的示意图是

难度: 中等查看答案及解析
-
下列反应属于放热反应的是:
①稀硫酸与氢氧化钾溶液反应 ②锌与稀硫酸的反应 ③生石灰变成熟石灰的反应 ④氢氧化钡晶体和氯化铵晶体混合反应 ⑤石灰石高温煅烧 ⑥灼热的炭与CO2反应⑦甲烷与O2的燃烧反应
A.①②③⑤ B.①②③⑦ C.①②⑤⑥⑦ D.④⑥
难度: 简单查看答案及解析
-
甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则下列热化学方程式中正确的是
A.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= +890KJ·mol—1
B.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= +890KJ·mol—1
C.CH4(g) + 2O2(g) == CO2(g) +2H2O(l) ΔH= -890KJ·mol—1
D.2CH4(g) + 4O2(g) == 2CO2(g) + 4H2O(l) ΔH= -890KJ·mol—1
难度: 中等查看答案及解析
-
把下列四种X溶液,分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,并加水稀释到50 mL。此时X和盐酸缓慢地进行反应,其中反应速率最快的是
A.20 mL 3 mol·L-1 B.20 mL 2 mol·L-1
C.10 mL 4 mol·L-1 D.10 mL 2 mol·L-1
难度: 中等查看答案及解析
-
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是
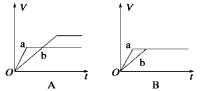
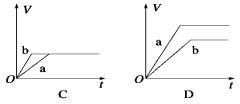
难度: 中等查看答案及解析
-
反应3X(g)+Y(g)
2Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.5mol,则此反应的平均速率v为
A.v (X)=0.05mol·L—1·min—1 B.v (Y)= 0.10mol·L—1·min—1
C.v (Z)=0.10mol·L—1·min—1 D.v (W)=0.05mol·L—1·s—1
难度: 中等查看答案及解析
-
已知:2H2(g)+O2(g)=2H2O(g) △H=-483.6KJ/mol。有关键能数据如下表:
化学键
H—H
O=O
键能/KJ▪mol-1
436
498
则水分子中O—H键键能
为
A.463.4KJ/mol B.926.8KJ/mol
C.221.6KJ/mol D.413KJ/mol
难度: 中等查看答案及解析
-
已知常温下,N2(气)和H2(气)生成2mol NH3(气)放出92.4 kJ热量。现有甲、乙两个容积相同的密闭容器,在常温下:①向密闭容器甲中通入1 molN2和3 mol H2,达到平衡时放出热量Q1kJ。②向密闭容器乙中通入0.5 mol N2和1
.5 mol H2,达到平衡时放出热量Q2kJ。则下列关系式正确的是
A.Q1=2Q2=92.4 B.Ql>2Q2 C.Q1<2Q2 D.Q1=2Q2≠92.4
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是
A.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq) + CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H = -57.4kJ·mol-1
B.已知C(石墨,s)= C(金刚石,s) △H>0,则石墨比金刚
石稳定
C.已知反应2H2(g) + O2(g) = 2H2O(l) △H=-571.6kJ·mol-1,则H2的燃烧热为571.6kJ·mol-1
D.已知2C(s)+2O2(g)=2CO2(g) △H1;2C(s)+O2(g)=2CO(g) △H2,则△H1>△H2
难度: 中等查看答案及解析
-
用CH4催化还原NOx可以消除氮氧化合物的
污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
下列说法中错误的是
A.等物质的量的CH4在反应①、②中转移电子数相同
B.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) △H>-574kJ/mol
C.4NO2(g)+2N2(g)=8NO(g) △H=+586kJ/mol
D.若用标准状况下4.48L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6NA
难度: 困难查看答案及解析
-
已知键能N≡N 946 kJ/mol ,H-H 436kJ/mol ,N-H 391 kJ/mol.从理论上计算2NH3(g)
N2(g)+3H2(g)的⊿H为
A.-46 kJ/mol B.-92 kJ/mol
C.+92 kJ/mol D.+1800kJ/mol
难度: 中等查看答案及解析
-
已知:(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1
(2)C(s)+O2(g)=CO2(g) △H2 (3)2H2(g)+O2(g)=2H2O(l) △H3
(4)2CO2
(g)+4H2(g)=CH3COOH(l)+2H2O(l) △H4
(5)2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H5
下列关于上述反应的焓变的判断正确的是
A.△H1>0,△H2<0 B.△H5=2△H2+△H3-△H1
C.△H3>0,△H5<0 D.△H4=△H1-2△H3
难度: 中等查看答案及解析