-
下列说法正确的是
A. 可以用FeCl3溶液和NaOH溶液反应制备Fe(OH)3胶体
B. FeCl3、FeCl2和Fe(OH)3都可以通过化合反应得到
C. 40gNaOH固体溶解于500mL水中,所得溶液的物质的量浓度为2mol/L
D. 根据电解质的水溶液导电能力的强弱将电解质分为强电解质和弱电解质
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 18 g D2O和18 g H2O中含有的质子数均为10NA
B. 2 L 0.5 mol·L-1亚硫酸溶液中含有的H+离子数为2NA
C. 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D. 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关,下列说法错误的是
A. “霾尘积聚难见路人”,雾霾所形成的分散系不具有丁达尔效应
B. “熬胆矾铁釜,久之亦化为铜”,该过程发生了氧化还原反应
C. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
D. 古剑“湛泸”“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金
难度: 中等查看答案及解析
-
二氧化氮是能引起酸雨的一种物质. 二氧化氮属于
A. 酸 B. 非金属氧化物 C. 碱 D. 混合物
难度: 中等查看答案及解析
-
下列反应中,氧化反应与还原反应在同一元素间进行的是
A.Cl2 + 2NaOH = NaCl + NaClO + H2O
B.Fe + CuSO4 = FeSO4 + Cu
C.2KClO3
2KCl + 3O2↑
D.2H2O
2H2↑+ O2↑
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 二氧化硅是人类将太阳能转换为电能的常用材料
B. SO2、NO2、NO、氟氯烃、CO2等均是造成大气污染的重要物质
C. HCl、H2SO4、HNO3均具有氧化性,都是氧化性酸
D. 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
难度: 简单查看答案及解析
-
下列实验能够完成实验目的的是
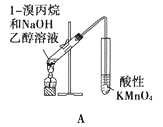
A. A装置用于检验溴丙烷消去产物
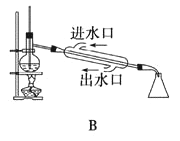
B. B装置用于石油的分馏
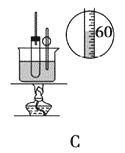
C. C装置用于实验室制硝基苯
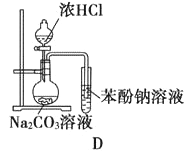
D. D装置可证明酸性:盐酸>碳酸>苯酚
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 向FeCl3溶液中滴加HI溶液:Fe3++2I-===Fe2++I2
B. 向AlCl3溶液中加入过量的氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
C. 向稀NH4HCO3溶液中加入过量NaOH溶液:NH4++OH-===NH3·H2O
D. 向苯酚钠溶液中通入少量CO2:
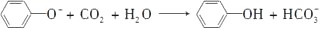
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 氯化钠溶液在电流作用下电离成Na+与Cl‑
B. 溶于水后能电离出H+的化合物都是酸
C. 氯化氢溶于水后能导电,但液态氯化氢不能导电
D. 导电性强的溶液中自由移动离子数目一定比导电性弱的溶液中自由移动离子数目多
难度: 中等查看答案及解析
-
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl,NaClO,NaClO3的混合液,经测定ClO-与ClO3-的物质的量浓度之比为1∶3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
A、21∶5 B、11∶3 C、3∶1 D、4∶1
难度: 中等查看答案及解析
-
取100 mL 1.0mol·L-1和200 mL 2.0 mol·L-1的盐酸混合后,全部注入500 mL的容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是
A. 0.5 mol·L-1 B. 1.0 mol·L-1 C. 1.5mol·L-1 D. 2.0 mol·L-1
难度: 中等查看答案及解析
-
新装修房屋会释放有毒的甲醛(HCHO)气体,银-Ferrozine法检测甲醛的原理如下:

下列说法正确的是
A. 22.4LCO2中含共价键数目为4NA
B. 30gHCHO被氧化时转移电子数目为2 NA
C. 该电池总反应的化学方程式为2Ag2O+HCHO=4Ag+CO2↑+H2O
D. 理论上,消耗HCHO和消耗Fe3+的物质的量之比4:1
难度: 困难查看答案及解析
-
下列反应中,SiO2作为氧化剂的是
A. SiO2+CaO===CaSiO3
B. SiO2+2NaOH===Na2SiO3+H2O
C. SiO2+2C
Si+2CO
D. SiO2+Na2CO3
Na2SiO3+CO2↑
难度: 简单查看答案及解析
-
把4.48 LCO2通过一定量的固体过氧化钠后收集到3.36L气体(标况下),则这3.36L气体的质量是
A. 3.8g B. 4.8g C. 5.6g D. 6.0g
难度: 中等查看答案及解析
-
将KCl和CrCl3两种固体混合物共熔,得化合物X。X由K、Cr、Cl三种元素组成。将1.892gX中的Cr全部氧化成Cr2O72-,Cr2O72-可从过量的KI溶液中氧化出2.667g碘单质(Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O)。向溶有1.892gX的溶液中加入过量的AgNO3溶液,可得4.52gAgCl沉淀。则表示X的化学式为
A. K3Cr2Cl9 B. K3Cr2Cl5 C. K3Cr2Cl7 D. K2CrCl4
难度: 困难查看答案及解析