-
相同温度下等物质的量浓度的下列溶液中,pH值最小的是
A. NH4CI B. NH4HCO3 C. NH4HS04 D. (NH4)2SO4
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. pH=1的溶液中:K+、Fe2+、MnO4-、SO42-
B. c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
C. c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D. 与铝反应生成氢气的溶液中:NH4+、K+、Cl-、SiO32-
难度: 中等查看答案及解析
-
下列各组实验中溶液最先变浑浊的是( )
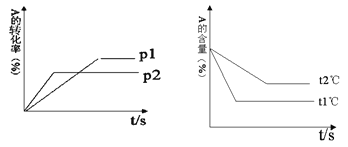
A. 0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度10℃
B. 0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度10℃
C. 0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度30℃
D. 0.2mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度30℃
难度: 简单查看答案及解析
-
下列关于铜电极的叙述正确的是( )
A. 铜锌原电池中铜是负极
B. 用电解法精炼粗铜时,粗铜作阴极
C. 在镀件上电镀铜时可用金属铜做阳极
D. 电解稀硫酸制H2和O2时铜做阳极
难度: 中等查看答案及解析
-
下列设备工作时,将化学能转化为热能的是( )
A.
 硅太阳能电池 B.
硅太阳能电池 B.  锂离子电池
锂离子电池C.
 太阳能集热器 D.
太阳能集热器 D.  燃气灶
燃气灶难度: 中等查看答案及解析
-
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是
A. 1L1mol/LMgCl2溶液中含有的Mg2+离子数为NA
B. 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA
C. 0.1mol/L稀硫酸中含SO42- 的数目为0.1NA
D. 标准状况下,11.2LNO和5.6LO2混合后,分子总数小于0.5NA
难度: 简单查看答案及解析
-
下列过程或现象与盐类水解无关的是 ( )
A. 纯碱溶液去油污
B. 加热稀醋酸溶液其pH 稍有减小
C. 小苏打溶液与AlCl3溶液混合产生气体和沉淀
D. 浓的硫化钠溶液有臭味
难度: 中等查看答案及解析
-
冰醋酸中加水稀释时,溶液中的氢离子浓度随加入的水量变化的下列各曲线图中,正确的是 ( )
A.
B.
C.
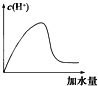 D.
D. 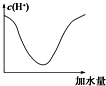
难度: 中等查看答案及解析
-
在密闭容器里,A与B反应生成C,其反应速率分别用
、
、
表示,已知2
=3
、3
=2
,则此反应可表示为
A. 2A+3B=2C B. A+3B=2C
C. 3A+B=2C D. A+B=C
难度: 中等查看答案及解析
-
可以充分说明反应P(g)+Q(g)
R(g)+S(g)在恒温下已达到平衡的是
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
难度: 中等查看答案及解析
-
对于0.1mol·L-1的Na2S溶液,下列判断正确的是 ( )
A.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-)
B.c(Na+)=2c(S2-)+c(OH-)+c(HS-)
C.向Na2S溶液中加水稀释,其所有离子的浓度都减小
D.向溶液中加入少量NaOH固体,能促进水的电离
难度: 困难查看答案及解析
-
在一密闭容器中发生反应:2A(g)+2B(g)
C(s)+3D(g) ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是( )
A. 移走少量C B. 扩大容积,减小压强
C. 缩小容积,增大压强 D. 容积不变,充入“惰”气
难度: 简单查看答案及解析
-
A. ⑥③①②⑤④ B. ⑤①②⑥④③ C. ⑤④③②①⑥ D. ③①②④⑤⑥
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
B. 相同温度时,1mol/L氨水与0.5mol/L氨水中,c(OH-)之比是2∶1
C. 已知2SO2(g)+ O2(g)
2SO3 (g)△H<0,该反应在任何温度下均可自发进行
D. 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1 AgNO3溶液,先生成Ag2CrO4沉淀
难度: 中等查看答案及解析