氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g) +H2O(g) CO(g)+3H2(g) △H= +216.4 kJ /mol
CO(g)+3H2(g) △H= +216.4 kJ /mol
b.CO(g) +H2O(g)  CO2(g)+H2(g) △H =-41.2 kJ/mol
CO2(g)+H2(g) △H =-41.2 kJ/mol
则反应CH4(g) +2H2O(g) CO2(g)+4H2(g) △H=_________。
CO2(g)+4H2(g) △H=_________。
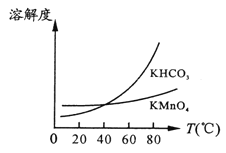
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如下图。

①恒压时,反应一定达到平衡状态的标志是______(填序号);
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.c(H2)/c(NH3) 比值保持不变 D.c(NH3)/c(N2) 等于2
②P1_____P2 (填“ > ”、“< ”、“=”,下同);反应平衡常数:B点____D点;
③在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:υ(A)______ υ(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO 反应生成N2H4的化学方程式__________;
②已知25℃时N2H4水溶液呈弱碱性:
N2H4+H2O N2H5++OH- K1= 1×10-a;
N2H5++OH- K1= 1×10-a;
N2H5++H2O N2H62++OH- K2=1×10-b。
N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围_________(用含a、b式子表示)。
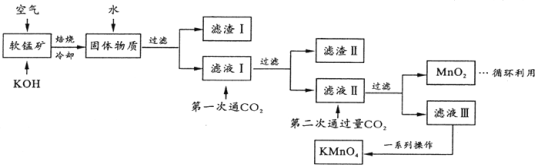
我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。
(1)Cu2+的未成对电子数有______个,H、O、S 电负性由大到小的顺序为_______。
(2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。[Cu(NH3)4]SO4中化学键类型有_______,阴离子中心原子杂化类型为______。
(3)铁铜合金晶体类型为_____;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因________________。
(4)金铜合金的一种晶体结构为立方晶型,如图所示。已知该合金的密度为d g/cm3,阿伏加德罗常数值为NA,两个金原子间最小间隙为a pm(1pm= 10-10cm)。则铜原子的半径为_______cm(写出计算表达式)。

用石油产品A(C3H6)为主要原料,合成具有广泛用途的有机玻璃PMMA。流程如下(部分产物和条件省略)
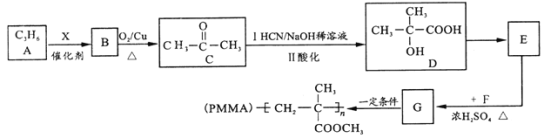
试回答下列问题:
(1)B的名称________; D 中官能团名称_________。
(2)E→G 的化学方程式为____,反应类型是_________。
(3)T是G的同分异构体,1molT与足量新制Cu(OH)2悬浊液反应最多生成2molCu2O沉淀,T的结构有________种(不含立体结构)。
(4)若高分子化合物PMMA 的相对分子质量为1.5×106,其聚合度为_______。
(5)参照上述流程,以 为原料合成
为原料合成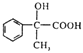 (其它原料自选)。设计合成路线:________________________。
(其它原料自选)。设计合成路线:________________________。




 (其它原料自选)。设计合成路线:________________________。
(其它原料自选)。设计合成路线:________________________。