-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
将氯气通入品红溶液
溶液红色褪去
氯气具有漂白性
B
将铜粉加入1.0mol•L﹣1
的Fe2(SO4)3溶液中
溶液变蓝,有黑色固体出现
金属Fe比Cu活泼
C
用坩埚钳夹住用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点比较低
D
向盛有少量浓硝酸、稀硝酸的两支试管中分别加入一片大小相同的铜片
浓硝酸中铜片很快开始溶解,并放出红棕色气体;稀硝酸中过一会铜片表面才出现无色气体,气体遇空气变红棕色
浓硝酸氧化性强于稀硝酸
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为 0.1 NA
B. 1 L 0.1 mol/L的 H2SO4溶液中氧原子的总数大于 0.4 NA
C. 58.5 g氯化钠晶体中含有 NA个氯化钠分子
D. 120 g NaHSO4晶体中阳离子和阴离子的总数为 3 NA
难度: 中等查看答案及解析
-
四种短周期主族元素A、B、M、N 的原子序数依次增大,其原子的最外层电子数之和为19,B 和A元素原子核的质子数之比为2:1,B和M的电子数之差为4。下列说法正确的是
A. 原子半径大小: N>M>B>A
B. A、M、N 三种元素形成的气态氢化物中最稳定的是N的气态氢化物
C. 由A 元素形成的单质的熔沸点都很高,硬度都很大
D. M、N 所形成的氧化物的水化物都是强酸
难度: 中等查看答案及解析
-
化学与生活、生产密切相关。下列说法正确的是
A. 硫酸铁净水的原理和漂白粉消毒的原理相同
B. 汽车尾气中的氮氧化物是汽油不完全燃烧造成的
C. 研制高性能的耐磨轮胎,可减少PM2.5等细颗粒物的产生
D. 应用高纯度单质硅制成光导纤维,可提高信息传输速度
难度: 中等查看答案及解析
-
根据下列实验现象,所得结论正确的是
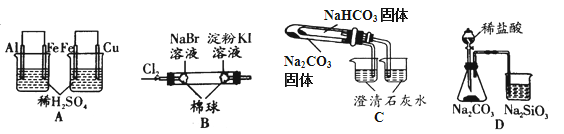
实验
实验现象
结论
A
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡
氧化性:Al3+>Fe2+>Cu2+
B
左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C
右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化
热稳定性:Na2CO3>NaHCO3
D
锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:Cl>C>Si
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
常温时,1 mol/L的HClO2和,1 mol/L的HMnO4两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,稀释后溶液体积为V,所得曲线如图所示。下列说法正确的是
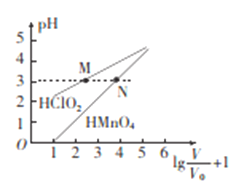
A. 稀释前分别用1mol·L-1的NaOH溶液中和,消耗的NaOH溶液体积:HMnO4>HClO2
B. 当稀释至pH均为3时,溶液中c(ClO2-)>c(MnO4-)
C. 在0≤pH≤5时,HMnO4溶液满足,pH=
D. 常温下,浓度均为0.1mol·L-1的NaClO2和NaMnO4溶液的pH: NaMnO4>NaClO2
难度: 困难查看答案及解析
-
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是

A. 电池工作时,正极反应式为O2+2H2O+4e-===4OH-
B. 电解时,电子流动路径是负极→外电路→阴极→溶液→阳极→正极
C. 试管中NaOH溶液用来吸收电解时产生的Cl2
D. 当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.021 mol气体
难度: 中等查看答案及解析
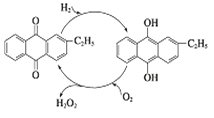
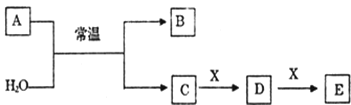
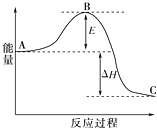
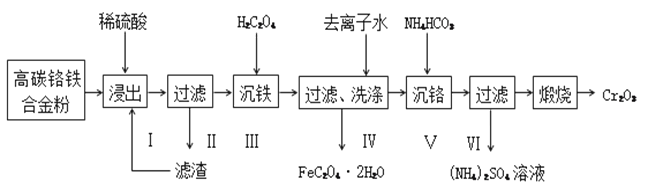

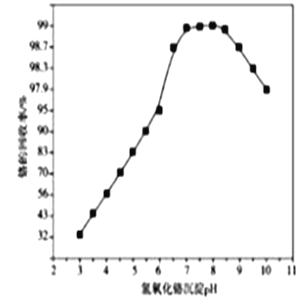
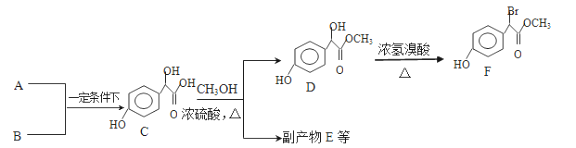
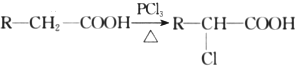 ,下列流程是A的一种合成方法,写出方框中各物质的结构简式:___________,
,下列流程是A的一种合成方法,写出方框中各物质的结构简式:___________,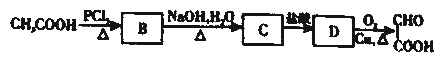 .
.