-
化学在当今生活中具有非常重要的作用。下列有关说法不正确的是
A. 利用新型陶瓷制造的人造骨属于新型无机非金属材料
B. 由反应4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-可知,新型水处理剂高铁酸钾(K2FeO4)集氧化、吸附、絮凝等多种功能于一体
C. 落户贵州的企业必须从源头上减少或消除生产对环境的污染,这是贵州省贯彻落实绿色化学观念的具体体现
D. 碳酸氢钠药片可用于治疗胃酸过多,与醋同服可提高疗效
难度: 简单查看答案及解析
-
下列关于有机化合物的说法中正确的是
A. 乙醇和乙二醇互为同系物
B. 聚氯乙烯能使溴水褪色
C. 油脂在碱性条件下的水解反应又称为皂化反应
D. 螺(33烷(
)的一氯代物共有3种(不含立体异构)
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 密闭容器中,2 mol NO和1molO2充分反应后分子总数为2NA
B. 标准状况下,2.24L甲醇在足量O2中完全燃烧,生成CO2的分子数为0.1NA
C. 常温常压下,28gCO含有的质子数为14NA
D. 常温常压下,30g乙烷含有的共价键数目为6NA
难度: 中等查看答案及解析
-
下列化学实验设计正确的是
A. 用氨水鉴别AlCl3溶液与AgNO3溶液
B. 用酸性高锰酸钾溶液区分 HCOOH和HCHO
C. 除去CO2气体中的SO2气体,将混合气体通入BaCl2溶液洗气
D. 一定量的稀HNO3与足量的Cu反应,尾气直接用NaOH溶液吸收
难度: 中等查看答案及解析
-
最近有科学家研发了一种新型锂空气电池,结构如下图所示。已知:①电解质由离子液体(离子能够自由移动,非溶液)和二甲基亚砜[(CH3)2SO]混合制成,可促进过氧化锂生成;②碳酸锂薄层的作用是让锂离子进入电解质,并阻止其它化合物进入该电极;③二硫化钼起催化作用。该装置工作时,下列叙述不正确的是
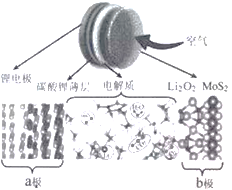
A. 放电时,a极发生氧化反应
B. 放电时的总反应为:2Li+O2=Li2O2
C. 充电时,Li+在电解质中由b极移向a极
D. 充电时,b极的反应式:Li2O2+2e-=2Li+O22-
难度: 中等查看答案及解析
-
a、b、c、d是原子序数依次增大的四种短周期主族元素,a原子中只有1个电子,b原子的L电子层有5个电子,c元素的最高化合价为其最低化合价绝对值的3倍。下列叙述正确的是
A. a、b、c三种元素形成的化合物都只含共价键
B. b的气态氢化物与d的气态氢化物相遇有白烟产生
C. c只以化合态形式存在于自然界中
D. 含氧酸的酸性:d的一定强于c的
难度: 中等查看答案及解析
-
常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断正确的是
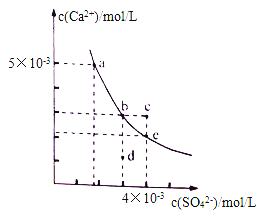
A. 曲线上任意一点的Ksp都相同
B. 在CaSO4饱和溶液中加入Na2SO4固体,可使溶液由b点变化到c点
C. 蒸发水后,可使溶液由d点变化到b点
D. 常温下,CaSO4的Ksp的数量级为10-5
难度: 中等查看答案及解析

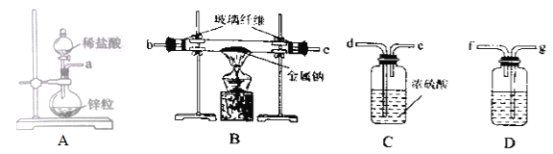

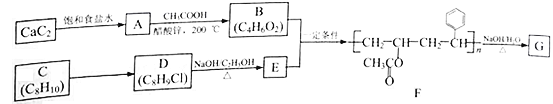
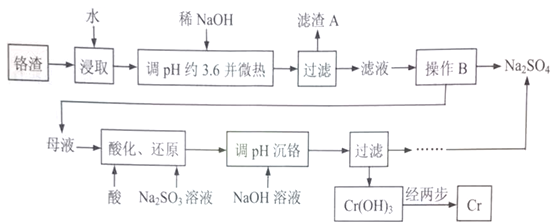
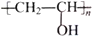 的合成线路图(无机试剂任选)__________________。
的合成线路图(无机试剂任选)__________________。