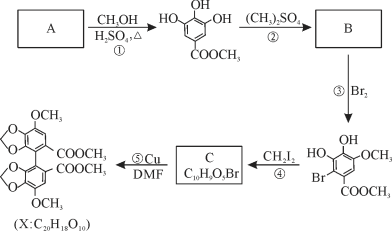
-
北宋沈括的《梦溪笔谈》对指南针已有详细记载:“方家以磁石磨针锋,则能指南。”磁石的主要成分是
A. Fe3O4 B. Fe2O3 C. FeO D. CuFeS2
难度: 简单查看答案及解析
-
化学与科技、生活密切相关。下列叙述中正确的是
A. 泰国银饰和土耳其彩瓷是“一带一路”沿线国家的特色产品,其主要成分均为金属材料
B. 从石墨中剥离出的石墨烯薄片能导电,因此是电解质
C. 中国天眼FAST用到的高性能碳化硅是一种新型的有机高分子材料
D. 国产大客机大规模使用先进的材料铝锂合金,该合金密度小,强度高
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A. 用醋酸检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
B. 漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3-
C. 用氢氧化钠溶液除去镁粉中的铝:2Al+2OH-+2H2O===2AlO
+3H2↑
D. Na2S溶液使酚酞试液变红:S2-+2H2O
2OH-+H2S
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法错误的是
A. 11 g D
O所含的电子数为5NA
B. 常温下,5.6 g铁与浓硝酸反应转移的电子数为0.3NA
C. 甲烷燃料电池正极消耗标况下11.2L O2时,电路中通过的电子数为2NA
D. 3H2(g)+N2(g)
2NH3(g) ΔH=-92 kJ·mol-1,当放出热量为92 kJ时,转移电子数为6NA
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A. 甲苯分子中所有原子在同一平面上
B. 糖类、油脂和蛋白质都属于高分子有机物
C. 食品工业以植物油和氢气为原料生产氢化植物油,利用了加成反应
D. CH3CH(C2H5)CH2CH(CH3)CH3的名称为2-甲基-4-乙基戊烷
难度: 中等查看答案及解析
-
下列说法正确的是
A. 增大反应物浓度,能增大活化分子百分数,所以反应速率增大
B. 使用合适的催化剂,能增大活化分子百分数,所以反应速率增大
C. 对于任何反应,增大压强都可加快反应速率
D. 升高温度,只能增大吸热反应的反应速率
难度: 简单查看答案及解析
-
常温下,等体积等pH的盐酸和氯化铵两溶液,下列说法正确的是
A. 两溶液导电能力相同
B. 分别与等量且同条件的锌反应,平均反应速率后者大
C. 稀释10倍后,盐酸的pH比氯化铵溶液的pH小
D. 分别与等浓度的氢氧化钠溶液恰好反应,消耗的氢氧化钠溶液的体积相同
难度: 中等查看答案及解析
-
短周期元素A、B、C、D的原子序数依次增大。X、Y、Z、W分别是由这四种元素中的两种组成的常见化合物,Y为淡黄色固体,W为常见液体;甲为单质,乙为红棕色气体;上述物质之间的转化关系如图所示(部分生成物已省略)。则下列说法中正确的是
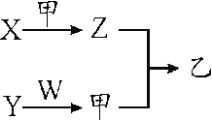
A. 沸点:W>X
B. 原子半径:D>C>B>A
C. C、D两种元素组成的化合物只含有离子键
D. A、B、C三种元素组成的化合物均为共价化合物
难度: 中等查看答案及解析
-
下列对定量实验误差的分析正确的是
A. 中和热测定实验中,缓慢地将NaOH溶液倒入盐酸中——测定结果无影响
B. 配制90 mL 1.0 mol·L-1 NaOH溶液,称取3.6 g NaOH固体配制——溶液浓度偏低
C. 酸碱中和滴定,盛标准液的滴定管滴定前尖嘴无气泡而滴定后有气泡——测定结果偏高
D. 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH——测定结果无影响
难度: 中等查看答案及解析
-
某有机物的结构简式如图所示。下列说法正确的是
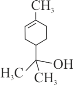
A. 该有机物催化加氢后的产物分子式为C10H18O
B. 该有机物发生消去反应可得到3种产物
C. 1 mol该有机物能与1 mol NaOH反应
D. 该有机物中碳原子上的氢原子的一氯代物的同分异构体有7种 (不考虑立体异构)
难度: 中等查看答案及解析
-
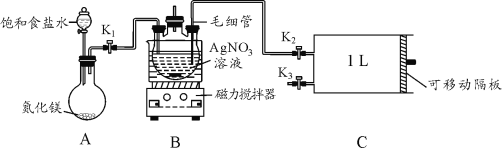
某小组设计如图所示装置(夹持装置略去),在实验室模拟侯氏制碱工艺中NaHCO3的制备。下列说法错误的是
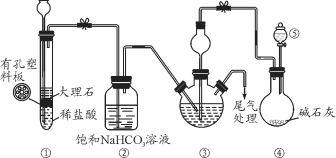
A. 装置①也可用于制取H2
B. ③、⑤中可分别盛放饱和食盐水和浓氨水
C. 应先向③中通入足量NH3,再通入足量CO2
D. ③中反应的离子方程式为NH3+CO2+H2O=NH4++HCO3-
难度: 中等查看答案及解析
-
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,设计并完成了如下实验。由此可知原溶液中
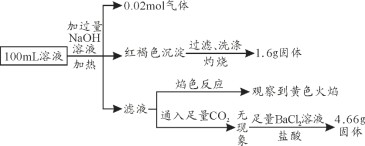
A. 原溶液中c(Fe3+)=0.1 mol·L-1
B. 要确定原溶液中是否含有Fe2+,其操作如下:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+
C. SO42-、NH4+、Na+一定存在,CO32-、Al3+一定不存在
D. 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2 mol·L-1
难度: 困难查看答案及解析
-
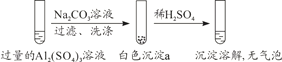
某学生探究0.25 mol·L-1 Al2(SO4)3溶液与0.5 mol·L-1 Na2CO3溶液的反应,实验如下。下列分析错误的是
实验1
实验2
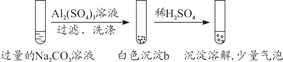
A. 实验1中,白色沉淀a是Al(OH)3
B. 实验2中,白色沉淀b中含有CO
C. 检验白色沉淀a、b是否洗涤干净,不可使用相同的检验试剂
D. 实验1、2中,白色沉淀成分不同可能与混合后溶液的pH有关
难度: 中等查看答案及解析
-
中国企业华为宣布:利用锂离子能在石墨烯表面和电极之间快速大量穿梭运动的特性,开发出石墨烯电池,电池反应式为LixC6+Li1-xCoO2
C6+LiCoO2,其工作原理如图。下列关于该电池的说法正确的是
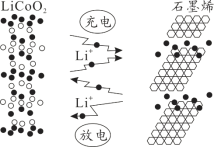
A. 该电池若用隔膜可选用阴离子交换膜
B. 石墨烯电池的优点是提高电池的储锂容量进而提高能量密度
C. 放电时,LiCoO2极发生的电极反应为:LiCoO2-xe-=Li1-xCoO2+xLi+
D. 对废旧的该电池进行“放电处理”让Li+嵌入石墨烯中而有利于回收
难度: 中等查看答案及解析
-
某温度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。下列有关说法正确的是
已知:Ksp(ZnS)=3×10-25
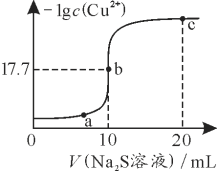
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
B. a、b、c三点对应的溶液中,水的电离程度最大的为b点
C. 该温度下,Ksp(CuS)=1×10-35.4
D. 向100 mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀
难度: 困难查看答案及解析