-
二甲醚作为燃料电池的原料,可通过以下途径制取:
I.2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH
CH3OCH3(g)+H2O(g) ΔH
II.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH
CH3OCH3(g)+3H2O(g) ΔH
(1)已知:①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
③CH3OCH3(g)+ H2O(g) 2CH3OH(g) ΔH3=+23.5kJ·mol-1
2CH3OH(g) ΔH3=+23.5kJ·mol-1
则反应I的ΔH=_______kJ·mol-1
(2)在10L恒容密闭容器中,均充入4molCO2和7molH2,分别以铱(Ir)和铈(Ce)作催化剂,通过反应II制二甲醚,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图1所示。
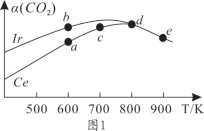
①根据图1,下列说法不正确的是________。
A.反应II的ΔH<0,ΔS>0
B.600K时,H2的速率:v(b)正>v(a)逆
C.分别用Ir、Ce作催化剂时,Ce使反应II的活化能降低更多
D.从状态d到e,α(CO2)减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=______(保留3位有效数字)。
(3)写出二甲醚碱性(电解质溶液为KOH溶液)燃料电池的负极电极反应式____________________________。
-
二甲醚作为燃料电池的原料,可通过以下途径制取:
I.2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH
CH3OCH3(g)+H2O(g) ΔH
II.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) ΔH
CH3OCH3(g)+3H2O(g) ΔH
(1)已知:①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
③CH3OCH3(g)+ H2O(g) 2CH3OH(g) ΔH3=+23.5kJ·mol-1
2CH3OH(g) ΔH3=+23.5kJ·mol-1
则反应I的ΔH=_______kJ·mol-1
(2)在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气发生反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是________。
CH3OCH3(g)+H2O(g),一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是________。
A.新平衡后c(CH3OCH3)增大
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大
(3)在10L恒容密闭容器中,均充入4molCO2和7molH2,分别以铱(Ir)和铈(Ce)作催化剂,通过反应II:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)制二甲醚,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示。
CH3OCH3(g)+3H2O(g)制二甲醚,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示。
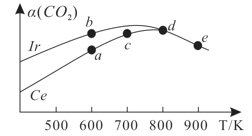
①根据图1,下列说法不正确的是________。
A.反应II的ΔH<0,ΔS>0
B.600K时,H2的速率:v(b)正>v(a)逆
C.分别用Ir、Ce作催化剂时,Ce使反应II的活化能降低更多
D.从状态d到e,α(CO2)减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=______(保留3位有效数字)。
(4)写出二甲醚碱性(电解质溶液为KOH溶液)燃料电池的负极电极反应式__________。该电池工作时,溶液中的OH-向______极移动,该电池工作一段时间后,测得溶液的pH减小。
(5)己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量.关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是________。
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
-
氢气既是一种清洁能源,又是一种化工原料,在国民经济中发挥着重要的作用。
(1)氢气是制备二甲醚的原料之一,可通过以下途径制取:
Ⅰ.2CO2(g)+6H2(g)⇌CH3OCH3(g)+3H2O(g) △H
Ⅱ.2CO(g)+4H2(g)⇌CH3OCH3(g)+H2O(g) △H
已知:①CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H1=akJ•mol-1
②CO(g)+H2O(g)⇌CO2(g)+H2(g) △H2=bkJ•mol-1
③CH3OCH3(g)+H2O(g)⇌2CH3OH(g) △H3=ckJ•mol-1
则反应Ⅱ的△H____kJ•mol-1
(2)氢气也可以和CO2在催化剂(如Cu/ZnO)作用下直接生成CH3OH,方程式如下CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),现将1molCO2(g)和3molH2(g)充入2L刚性容器中发生反应,相同时间段内测得CH3OH的体积分数φ (CH3OH)与温度(T)的关系如图所示:
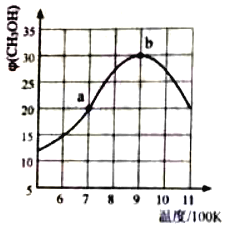
①经过10min达到a点,此时CH3OH的体积分数为20%.则v(H2)=___(保留三位小数)。
②b点时,CH3OH的体积分数最大的原因是___。
③b点时,容器内平衡压强为 P0,CH3OH的体积分数为30%,则反应的平衡常数Kp=___(用平衡分压代替平衡浓度计算,分压=总压×体积分数)
④a点和b点的v逆,a__b(填“>”“<”或”=”)若在900K时,向此刚性容器中再充入等物质的量的CH3OH和H2O,达平衡后φ(CH3OH)___30%。
⑤在900K及以后,下列措施能提高甲醇产率的是____(填字母)
a.充入氦气 b.分离出H2O c.升温 d.改变催化剂
(3)H2还可以还原NO消除污染,反应为2NO(g)+2H2(g)⇌N2(g)+2H2O(g),该反应速率表达式v=k•c2(NO)•c(H2)(k是速率常数,只与温度有关),上述反应分两步进行:
i.2NO(g)+H2(g)⇌N2(g)+H2O2(g)△H1;ii.H2O2(g)+H2(g)⇌2H2O(g)△H2化学总反应分多步进行,反应较慢的一步控制总反应速率,上述两步反应中,正反应的活化能较低的是___(填“i”或“ii”)
-
二甲醚(CH3OCH3)--空气燃料电池的工作原理如右图所示。电池工作时,下列说法正确的是

A. a极区溶液的pH变大
B. b极有H2O生成
C. a极反应式:CH3OCH3+3O2--12e-=2CO2↑+6H+
D. 每消耗11.2LO2(标准状况),有2molH+向左侧移动
-
以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示。已知:a电扱的反应式为O2+4H++4e-=2H2O,下列说法不正确的是
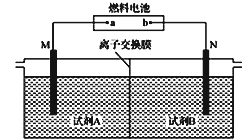
A. b电极的反应式为CH3OCH3+3H2O-12e-==2CO2↑+12H+
B. 试剂A为饱和食盐水,试刑B为NaOH稀溶液
C. 阳极生成1 mol气体时,有1mol离子通过离子交换膜
D. 阴极生成1 mol气体时,理论上导线中流过2 mol e-
-
以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示。已知:a电扱的反应式为O2+4H++4e-=2H2O,下列说法不正确的是
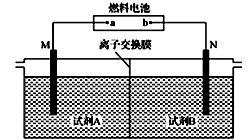
A. b电极的反应式为CH3OCH3+3H2O-12e-==2CO2↑+12H+
B. 试剂A为饱和食盐水,试刑B为NaOH稀溶液
C. 阳极生成1 mol气体时,有1mol离子通过离子交换膜
D. 阴极生成1 mol气体时,理论上导线中流过2 mol e-
-
日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性.电池总反应为:CH3OCH3+3O2=2CO2+3H2O,电池示意如图,下列说法不正确的是( )
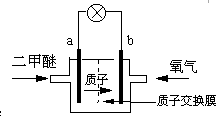
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H++O2+4e-=2H2O
D.电池工作时,1mol二甲醚被氧化时就有6mol电子转移
-
一种碱性“二甲醚(CH3OCH3)燃料电池”具有启动快、能量密度高、效率高等优点,其电池总反应为: CH3OCH3+3O2+4OH-=2CO32-+5H2O,下列说法不正确的是
A. 电池正极可用多孔碳材料制成
B. 电池负极发生的反应为: CH3OCH3-12e-+3H2O==2CO32-+12H+
C. 理论上,1mol二甲醚放电量是1mol甲醇放电量的2倍
D. 电池工作时,OH-向电池负极迁移
-
(14分)二甲醚(CH3OCH。)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
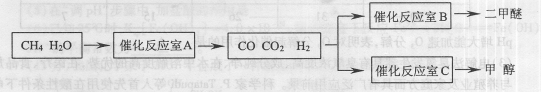
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为________.
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g) CO(g)+3H2(g)……(I)、CO(g)+H2O(g)
CO(g)+3H2(g)……(I)、CO(g)+H2O(g) CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO2(g)+H2(g)……(Ⅱ)催化反应室C中发生的反应为:
CO(g)+2H2(g) CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g)
CH3OH(g)……(Ⅲ)、CO2(g)+3H2(g) CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率= ×100%,试求反应(Ⅳ)的原子利用率为________。
×100%,试求反应(Ⅳ)的原子利用率为________。
②反应(Ⅳ)的△S ________0(填“>”、“=”或“<”)。
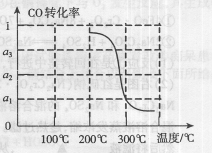
③在压强为5MPa,体积为VL的反应室c中,amol CO与20mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如右图。则该反应的△H________0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K= ________(用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。
该燃料电池负极的电极反应式为:
CH3OCH3一12e一+16OH一=2CO2-3+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通人电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下VL的废气,计算消耗二甲醚的质量。
-
下图是一种新型的质子交换膜二甲醚燃料电池(DDFC)。电池总反应为:CH3OCH3+3O2=2CO2+3H2O,下列说法不正确的是
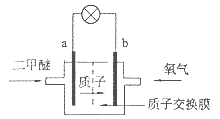
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H++O2+4e-=2H2O
D.电池工作时,1 mol二甲醚被氧化时就有6 mol电子转移
CH3OCH3(g)+H2O(g) ΔH
CH3OCH3(g)+3H2O(g) ΔH
CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
2CH3OH(g) ΔH3=+23.5kJ·mol-1









