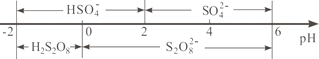
-
25℃时,下列溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol/L的KHA溶液pH=10:c(HA-)>c(OH-)>c(H+)>c(A2-)
B. 0.1mol/LNaHS溶液:c(S2-)=c(H+)+c(H2S)
C. 100mL1.0mol/LFe(NO3)2溶液和10mL2.0mol/LHNO3溶液混合后:c(NO3-)=2.0 mol/L
D. 0.1mol/LCH3COOH溶液和0.1mol/LCH3COONa溶液等体积混合pH<7:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
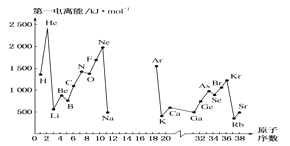
已知短周期主族元素X、Y、Z、W、R,其中X的原子半径在短周期主族元素中最大, Y元素的原子最外层电子数为m,次外层电子数为n,Z 元素的原子L层电子数为m+n,M层电子数为m-n,W与Z同主族,R 元素原子与Y元素原子的核外电子数之比为2∶1。下列叙述错误的是
A. Y的氢化物比R的氢化物稳定,且熔沸点高
B. RY2、WY2通入BaCl2溶液中均有白色沉淀生成
C. Z、W、R 最高价氧化物对应水化物的酸性:R>W>Z
D. X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质
实际应用
A.
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B.
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C.
次氯酸盐具有氧化性
漂白粉漂白织物
D.
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
难度: 中等查看答案及解析
-
下列表达式错误的是
A. 甲烷的电子式:
B. 碳原子的L层电子轨道表示式:
C. 硫离子的核外电子排布式:1s22s22p63s23p6
D. 碳-12原子:
难度: 简单查看答案及解析
-
能正确解释下列反应原理,并且书写正确的离子方程式是
A. 用明矾作净水剂:Al3++3H2O=Al(OH)3↓+3H+
B. 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O
C. 电解MgCl2饱和溶液制取Mg:MgCl2
Mg+Cl2↑
D. 用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-=CaCO3+SO42-
难度: 中等查看答案及解析
-
下列说法正确的是
A. 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B. 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应
C. 对于反应①C+CO2
2CO(△H>0)和反应②N2+3H2
2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢
D. NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+
难度: 中等查看答案及解析
-
反应mA(s)+nB(g)
pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率
③x点比y点时的反应速率慢 ④n>p
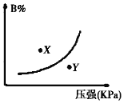
A. ①② B. ②④ C. ②③ D. ①③
难度: 中等查看答案及解析
-
标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。
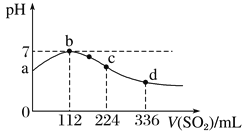
下列分析正确的是
A. 原H2S溶液的物质的量浓度为0.05 mol/L
B. 氢硫酸的酸性比亚硫酸的酸性强
C. b点水的电离程度比c点水的电离程度大
D. a点对应溶液的导电性比d点强
难度: 中等查看答案及解析
-
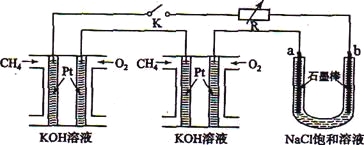
海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如图所示。下列说法正确的是
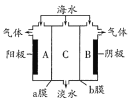
A. B极室产生的气体可使湿润的KI淀粉试纸变蓝
B. A极室产生氧气并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. b膜是阳离子交换膜
难度: 困难查看答案及解析
-
有关滴定的说法正确的是
A. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中混有NaOH杂质,则结果偏低。
B. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高锰酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为
mol/L
C. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
D. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
难度: 困难查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
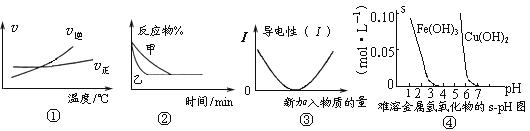
A. 根据图①可判断可逆反应“A2(g)+3B2(g)
2AB3(g)”的ΔH>0
B. 图②表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强大
C. 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D. 根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
难度: 困难查看答案及解析
-
如图表示可逆反应N2(g)+3H2(g)
2NH3(g) ΔH<0达平衡后,改变某一反应条件,反应速率随时间变化的情况。根据曲线判断下列说法中正确的是
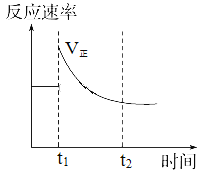
A. t1时降低了温度,平衡向正反应方向移动
B. t1时增大了压强,平衡向正反应方向移动
C. t1时增大了N2的浓度同时减小了NH3的浓度,平衡向正反应方向移动
D. t1时可能使用了催化剂
难度: 中等查看答案及解析
-
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。已知t ℃时AgCl的Ksp=4×10-10,下列说法正确的是( )
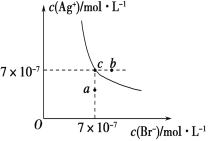
A. 加入NaBr固体,AgBr的溶解度减小,Ksp也减小
B. 在AgBr饱和溶液中加入固体NaBr,可使溶液中c点变到b点
C. 图中a点对应的是有AgBr沉淀生成
D. 在t ℃时,AgCl(s)+Br-(aq) ⇌AgBr(s)+Cl-(aq)的平衡常数K≈816
难度: 中等查看答案及解析
-
柠檬酸(用H3R表示)是一种高效除垢剂,现用一定浓度的柠檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的含量随pH的变化如图所示。下列说法正确的是

A. H3R的第二步电离常数Ka2(H3R)的数量级为10-4
B. Na2HR溶液中HR2-的水解程度大于电离程度
C. pH=6时,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D. pH=4时,c(H+)=c(H2R-)+2c(HR2-)+c(OH-)
难度: 中等查看答案及解析
-
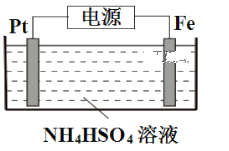
如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
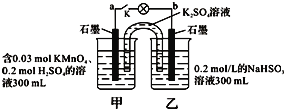
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯发生的反应为MnO4- + 3e- + 4H+ = MnO2 + 2H2O
D.乙池中的氧化产物为SO42-
难度: 中等查看答案及解析
-
将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g)
2SO3(g) △H<0
实验
编号
温度/℃
平衡常数
起始量/mol
平衡量/mol
达到平衡所需时间/min
SO2
O2
SO2
O2
1
T1
K1
4
2
x
0.8
6
2
T2
K2
4
2
0.4
y
t
下列说法中不正确的是
A. x=2.4
B. T1、T2的关系:T1>T2
C. K1、K2的关系:K2>K1
D. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
难度: 中等查看答案及解析