-
下列离子在指定溶液中可能大量共存的是
A. c(H+)=0.1mol/L溶液中:K+、Fe2+、NO3-、SO32-
B. 某无色透明溶液中: Fe3+、NH4+、NO3-、SCN-
C. 能使酚酞变红的溶液中: Na+、Cl-、SiO32-、NO3-
D. c(OH-)=0.1mol/L溶液中: HCO3-、K+、Na+、AlO2-
难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的总反应为3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O。下列说法正确的是
A. O2、S2O32-都是氧化剂 B. x=2
C. 每转移3mol电子,有1.5molFe2+被氧化 D. 氧化产物只有S4O62-
难度: 困难查看答案及解析
-
下列各组数值或物理量中,都不随水的“物质的量”的变化而变化的是
A. 水的沸点;水分子的数目 B. 水的质量;水的相对分子质量
C. 水的体积;水中所含原子的数目 D. 水的密度;水的摩尔质量
难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
A. 焰火中呈现的绚丽色彩,是金属元素焰色反应形成的
B. 小苏打既是制作糕点的膨松剂,还是治疗胃酸过多的一种药剂
C. 氯气、明矾是水处理过程中常用的两种化学试剂,两者的作用原理相同
D. 装运乙醇的包装箱上应贴上易燃液体的危险品标志图标
难度: 简单查看答案及解析
-
进行化学实验必须注意安全,下列说法不正确的是
A. 金属钠着火时,可立即用干燥的沙土覆盖
B. 温度计不慎打破,散落的水银应用硫粉处理后收集
C. 洒在桌面上的酒精燃烧,立即用湿抹布盖灭
D. 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
难度: 中等查看答案及解析
-
某化学兴趣小组同学对有关物质的分类进行讨论辨析,下列说法正确的是
A. BaSO4、CH3COONH4都属于强电解质
B. SiO2、NO2都属于酸性氧化物
C. NaCl溶液、牛奶都属于溶液
D. CuSO4·5H2O、水玻璃都属于纯净物
难度: 中等查看答案及解析
-
下列物质露置于空气中易变质的是
①氯水 ②水玻璃 ③烧碱 ④漂白粉 ⑤绿矾 ⑥亚硫酸钠
A. 除⑤外 B. 除②③外 C. 除②③⑥外 D. 全部易变质
难度: 中等查看答案及解析
-
下列因果关系表述正确的是
A. 硅晶体具有半导体性能,可用于光导纤维
B. 常温下铁遇浓硝酸钝化,可用铁质容器贮运浓硝酸
C. 浓硫酸具有吸水性,故能使蔗糖炭化
D. SO2具有漂白性,所以SO2能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
有NH4Cl、FeCl2、FeCl3 、Na2SO4、AlCl3五种溶液,用一种试剂就可以将它们鉴别出来,这种试剂是
A. H2SO4 B. Ba(OH)2 C. AgNO3 D. KSCN
难度: 中等查看答案及解析
-
下列有关反应的离子方程式正确的是
A. 氯气溶于水:Cl2+H2O=H++Cl-+HClO
B. Fe溶于足量稀HNO3:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
C. 氢氧化钡溶液与硫酸溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. 过氧化钠投入水中:Na2O2+2H2O=O2↑+2OH-+2Na+
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,22.4LH2O含有的分子数为NA
B. 标准状况下,22.4LCO2和O2混合气体中含氧原子数为2NA
C. 常温常压下,7.8g Na2O2固体中含有的阴离子数为0.2 NA
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
难度: 困难查看答案及解析
-
下列实验结论正确的是
A. 某溶液加入苯,苯层显紫色,证明原溶液中存在I-
B. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
C. 检验某溶液中是否含有SO42-时,为排除某些离子的干扰,可以先加稀盐酸将溶液酸化,无明显现象后再滴入氯化钡溶液,看是否生成白色沉淀
D. 一块表面打磨过的铝箔在酒精灯上加热至熔化,液态铝不会滴落,证明铝的熔点高于三氧化二铝
难度: 中等查看答案及解析
-
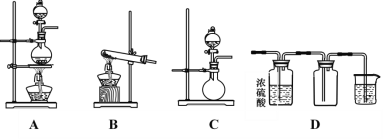
下列实验能达到目的的是
A
B
C
D
实验室制备Fe(OH)2
实验室制氨气
制过氧化钠
验证浓H2SO4的脱水性、强氧化性


A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是
①NaHCO3 ②(NH4)2SO3 ③Al2O3 ④Al(OH)3 ⑤Al ⑥NaAlO2 ⑦SiO2
A. ①②③④⑤ B. ①③④⑤ C. ①③④⑤⑥ D. 全部
难度: 困难查看答案及解析
-
下列除去杂质的实验方法正确的是(括号里为杂质)( )
A. Cl2( HCl):通入饱和NaHCO3溶液 B. K2CO3( NaHCO3):置于坩埚中加热
C. FeCl2( FeCl3):加入足量铜粉,过滤 D. NaCl( I2):加入CCl4后,振荡、静置分液
难度: 困难查看答案及解析
-
1L 1mol/L KOH溶液吸收0.8mol CO2,所得溶液中CO32-与HCO3-的物质的量浓度之比为
A. 1∶3 B. 2∶1 C. 2∶3 D. 3∶2
难度: 中等查看答案及解析
-
已知①中盛有一定量的碳酸钠溶液, 根据下图所示的实验过程,下列说法正确的是( )

A. ②中溶液为无色
B. ③中溶液的溶质组成有2种情况
C. ④中溶液的溶质除酚酞外,还有3种
D. 加入过量稀盐酸后,③中只观察到沉淀消失,产生大量气泡
难度: 困难查看答案及解析
-
如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
选项
W
X
Y
Z
A
S
SO2
SO3
H2SO4
B
Na
Na2O2
NaOH
NaCl
C
Fe
FeCl3
Fe(OH)2
FeCl2
D
Al
AlCl3
NaAlO2
Al2(SO4)3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在硫酸铁溶液中,加入少量铜粉至完全溶解后,又加入一定量铁粉,充分反应后有残余固体,则下列判断正确的是
A. 最后得到的溶液中只含Cu2+
B. 残余固体可能为铁、铜混合物
C. 残余固体一定全部是铜
D. 最后得到的溶液中含有Fe3+
难度: 困难查看答案及解析
-
某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1.5 mol Fe,充分反应(已知NO3-被还原为NO),最终溶液体积为1L。下列说法正确的是
A. 所得溶液中c(NO3-)=2.75 mol·L-1
B. 所得溶液中c(Fe2+):c(Fe3+)=1:2
C. 反应后生成NO的体积为33.6 L(标准状况下)
D. 所得溶液中的溶质只有FeSO4
难度: 困难查看答案及解析