-
化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。某化学课外活动小组为了验证元素化学性质递变规律,进行如下实验探究。
探究:验证氯元素的非金属性比硫元素的非金属性强,设计如下实验:
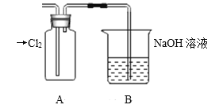
(1)装置A中盛放的试剂是____(填选项),化学反应方程式是___。
A.Na2SO3溶液 B.Na2S溶液 C.Na2SO4溶液
(2)下列不能用于验证氯元素比硫元素非金属性强的依据为______(填选项)。
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S大④HCl的还原性比H2S弱⑤HClO4的酸性比H2SO4强 ⑥还原性:Cl-<S2- ⑦Cl2能与H2S反应生成S ⑧在周期表中Cl处于S同周期的右侧
(3)若要验证非金属性:Cl>I,装置A中加入淀粉碘化钾混合溶液,观察到装置A中溶液_______的现象,即可证明。用元素周期律理论解释非金属性Cl>I的原因:_________。
-
化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。
I.实验室欲用 NaOH 固体来配制240 mL1 mol·L−1 的 NaOH 溶液。
(1)配制过程中使用的仪器除托盘天平、烧杯、玻璃棒、量筒、胶头滴管外,还必须用到的玻璃仪器有________________。
(2)需要用托盘天平称量NaOH 固体的质量为___________g。
(3)在配制过程中,若其他操作均正确,则下列操作会引起结果偏高的是__________________。
A.氢氧化钠固体潮解
B.未等 NaOH 溶液冷却至室温就转移到容量瓶中
C.没有洗涤烧杯和玻璃棒
D.定容时俯视刻度线
II.如图A、B、C是实验室常见的气体发生装置:
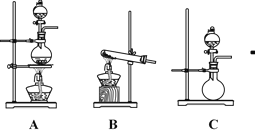

(1)①若用Ca(OH)2固体和NH4Cl固体制取少量NH3,选用的发生装置是_________(填序号)产生NH3的化学方程式为__________________________________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:发生装置→___→___,______→_____→i(按气流方向,用小写英文字母表示)。
(2)①若用A装置制取Cl2,产生Cl2的离子方程式为__________________________________
②要制得干燥氯气,可选用的干燥剂是_______
A.无水CaCl2 B.碱石灰 C.浓硫酸 D.无水CuSO4
③Cl2有毒,为防止其污染环境,可将尾气通过盛有________溶液的洗气瓶。
-
化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。
I.实验室配制220mL 1 mol·L-1的稀H2SO4溶液:
(1)用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为________mL。
(2)配制该溶液时需用的主要仪器有量筒、烧杯、玻璃棒、________、________等。
(3)误差下列情况使配制结果偏大的是________。
①溶解后未冷却即转移、定容
②定容时仰视容量瓶刻度线
③用量筒量取一定体积的浓硫酸时俯视
④将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶
II.如图A、B、C是实验室常见的几种气体发生装置:
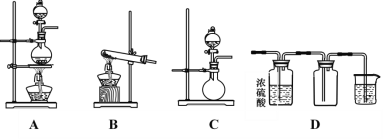
(1)实验室如果用B装置制备氨气,其化学方程式是___________________________。
(2)若想制得干燥的氨气,应选用的干燥剂是_______(填序号,下同)。
①无水CaCl2 ②碱石灰 ③浓硫酸 ④无水CuSO4
(3)若用A装置与D装置相连制备并收集X气体,则X可以是下列气体中的_______。
①CO2 ②NO ③Cl2 ④H2
其中在D装置中连接小烧杯的目的是________________________________。
III.某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
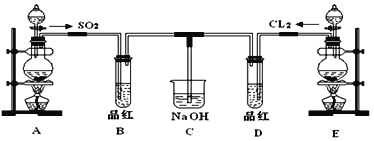
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:_____________________________,D:________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:_____________________________,D:________________________。
(2)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________。
(3)若E装置中开始加入200mL 11.8 mol·L-1的浓盐酸和足量的MnO2固体,反应后的混合物经过滤所得溶液,加入足量的AgNO3溶液,所得沉淀的物质的量的范围为_____________mol。
-
化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。
I.实验室配制220mL 1 mol·L-1的稀H2SO4溶液:
(1)用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为________mL。
(2)误差下列情况使配制结果偏大的是________。
①溶解后未冷却即转移、定容
②定容时仰视容量瓶刻度线
③用量筒量取一定体积的浓硫酸时俯视
④将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶
II.某研究性学习小组在查阅资料时发现:化工厂常用氨气来检验氯气是否泄漏。于是他们设计实验探究氯气与氨气之间的反应。制备气体的实验装置有(可重复选用):
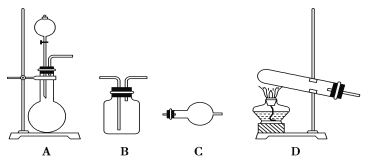
实验药品有:a.MnO2(s) b.浓盐酸 c.NH4Cl(S) d.KClO3(s) e.碱石灰 f.浓硫酸 g.饱和食盐水 h.NaOH(s) i.消石灰
请回答下列问题。
(1)利用上述实验装置与药品制备干燥氨气,应选用的装置有________(填字母序号)。发生反应的化学方程式为_________________________________。
(2)制取干燥氯气的装置由A、B、B组装而成,则B中应装的试剂依次是________(填字母序号) 。
(3)为使氯气、氨气在如图所示装置中充分混合并反应,在a口通入的气体是_______,若氨气量较多,则瓶内会出现大量白烟,该白烟为___________。

(4)已知,在水溶液中能发生反应3Cl2+2NH3===N2+6HCl,若氯气过量,氯气与氨气反应生成两种化合物,其中一种化合物分子的空间构型与NH3相似,则该反应的化学方程式为______________________________________。
-
(15分)二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。

(1)实验室用图1装置测定SO2催化氧化为SO3的转化率。(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作: 。
②实验过程中,需要通入氧气。试写出一个用如图2所示装置制取氧气的化学方程式: 。
③当停止通入SO2熄灭酒精灯后,需要继续通一段时间的氧气,其目的是: 。
④实验结束后,若装置D增加的质量为mg,装置E中产生白色沉淀的质量为ng,则此
条件下二氧化硫的转化率是 (用含字母的代数式表示,不用化简)。
(2)某学习小组设计用如图3装置验证二氧化硫的化学性质。
①能说明二氧化硫具有氧化性的实验现象为: 。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分三份,分别进行如下实验。
方案I:向第一份溶液中加入AgNO3溶液,有白色沉
淀生成。
方案II:向第二份溶液中加入品红溶液,红色褪去。
方案III:向第三份溶液中加入BaC12溶液,产生白色沉淀
上述方案中合理的是 (填“I”、“II”、或“III”);
试管b发生反应的离子方程式: 。
③当通入二氧化硫至试管c中溶液显中性时,该溶液中
c(Na+)= (用含硫微粒浓度的代数式表示)。
-
实验探究是学习化学的一个重要方法,某实验小组的同学利用下列装置完成一些常见气体制备以及相关物质性质探究(夹持装置及连接橡胶管已省略,其中装置E有多个供使用)。

可供选择的液体试剂及固体药品:
| 液体试剂 | 固体药品 |
| 稀硫酸、稀盐酸、稀硝酸、NaOH溶液、浓氨水、5%H2O2溶液、浓盐酸、饱和食盐水 | CaCO3、CaO、MnO2、KMnO4、 碱石灰、Cu、Zn、Na2S |
请回答下列问题:
(1)已知氨气和氯气在常温下可以发生氧化还原反应,A、B分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气的反应装置,则仪器的连接顺序是A→ →C← ← ←B。
(2)完成上述实验需选用仪器D和E,D中选用 ,E中选用 (填写序号)。
a.无水氯化钙 b.饱和碳酸氢钠溶液 c.饱和食盐水
d.五氧化二磷 e.碱石灰 f.浓硫酸
(3)C内出现大量白烟,另一种生成物常用作食品包装袋内的保护气,请写出反应的化学方程式 。
(4)请你利用所学化学知识设计一个实验方案检验白烟物质中的离子 。
-
(6分)我们已经学过氢气、氧气、二氧化碳、氯气、二氧化硫、氨气等气体的制备方法和化学性质。以下是实验室制备、洗涤、干燥气体及进行尾气处理的的常见仪器装置。
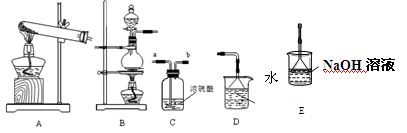
结合所学知识回答下列问题:
(1)下列气体中,只能用碱石灰干燥的是 (填字母)。
A.H2
B.Cl2
C.SO2
D.NH3
E.O2
(2)实验室用软锰矿(主要成分是MnO2)与浓盐酸混合加热制得氯气,所选制备装置是 ,尾气处理装置是 。氯气溶于水得到氯水,氯水成分中有三种分子四种离子,其中的四种离子是 。
(3)实验室用氯化铵和熟石灰制取氨气,其化学反应方程式是 ;检验收集氨气已满的常用方法是 (任写一种)。
-
我们已经学过氢气、氧气、二氧化碳、氯气、二氧化硫、氨气等气体的制备方法和化学性质.以下是实验室制备、洗涤、干燥气体及进行尾气处理的常见仪器装置.请结合所学知识回答下列问题:
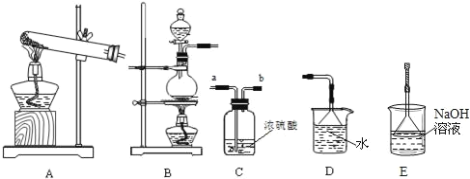
(1)下列气体中,只能用碱石灰干燥的是 ______ (填字母)
A.H2B.Cl2C.SO2D.O2
(2)实验室制取氯气反应原理的离子方程式是______,所选制备装置是______。检验氯气用______试纸;尾气处理的离子方程式为___________。
(3)实验室用氯化铵和熟石灰制取氨气,其化学反应方程式____________。工业上用氯气与石灰乳反应制备漂白粉的化学方程式为____________。
-
我们已经学过氢气、氧气、二氧化碳、氯气、二氧化硫、氨气等气体的制备方法和化学性质.以下是实验室制备、洗涤、干燥气体及进行尾气处理的常见仪器装置.请结合所学知识回答下列问题:

(1)下列气体中,只能用碱石灰干燥的是______(填字母).
A.H2 B.Cl2 C.SO2 D.NH3 E.O2
(2)实验室用软锰矿(主要成分是MnO2)与浓盐酸混合加热制得氯气,所选制备装置是______,干燥氯气的装置是______,尾气处理装置是______.
(3)实验室用氯化铵和熟石灰制取氨气,其化学反应方程式为______ CaCl2+2NH3↑+2H2O
-
下列说法错误的是
A. 化学是近代人类新发现的一门科学
B. 假说是研究物质性质的基本方法之一
C. 在研究氯气的性质时,发现有刺激性气味,该过程使用了观察法
D. 化学家可以操纵分子和原子,制造出自然界中不存在的物质










