-
下列关于常见有机物的说法正确的是
A. 淀粉水解与纤维素水解得到的最终产物不相同
B. 蛋白质、纤维素、蔗糖、油脂都是高分子化合物
C. 乙酸和油脂都能与NaOH溶液反应
D. 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别
难度: 简单查看答案及解析
-
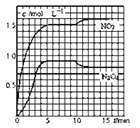
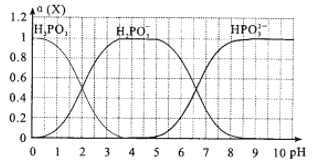
已知某温度下,四种一元弱酸的电离平衡常数为:Ka(HCN)=6.2×10-10 mol/L、Ka(HF)=6.8×10-4 mol/L、Ka(CH3COOH)=1.8×10-5 mol/L、Ka(HNO2)=6.4×10-6 mol/L。物质的量浓度都为0.1 mol/L的下列溶液中,pH最小的是( )
A. HCN B. CH3COOH C. HF D. HNO2
难度: 中等查看答案及解析
-
用蒸馏水逐步稀释0.2 mol/L的稀氨水时,若温度不变,在稀释过程下列数据始终保持增大趋势的是( )
A.c(OH-) B.c(NH4+) C.c(NH3·H2O) D.c(NH4+)/c(NH3·H2O)
难度: 中等查看答案及解析
-
下列离子方程式中属于盐类水解反应的是
①NH3+H2O
NH4++OH- ②HCO3-+H2O
H2CO3+OH-
③HCO3-+H2O
H3O++CO32- ④Fe3++3HCO3-
Fe(OH)3↓+3CO2↑
⑤NH4++2H2O
NH3•H2O+H3O+
A. ②④⑤ B. ②③④⑤ C. ①③⑤ D. ①②③⑤
难度: 简单查看答案及解析
-
下列化学用语表述正确的是
A. 次氯酸的电离方程式:HClO=H++ClO-
B. 铝溶于烧碱溶液的离子方程式:Al+2OH-=AlO2-+H2↑
C. 电解精炼铜的阴极反应式:Cu-2e-=Cu2+
D. 已知中和热为57.3 kJ/mol,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH (aq)= Na2SO4 (aq)+2H2O ( l ) ΔH=-114.6 kJ/mol
难度: 简单查看答案及解析
-
在一定温度下,对可逆反应A (g)+3B (g)
2C (g) 的下列叙述中,能说明反应已达到平衡的是
A. 单位时间消耗2amol C,同时生成3a mol B B. v正(A)=2v正(C)
C. v正(A)= 3v逆(B) D. 混合气体的物质的量不再变化
难度: 简单查看答案及解析
-
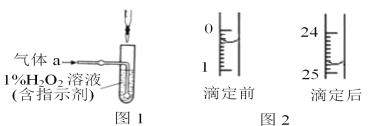
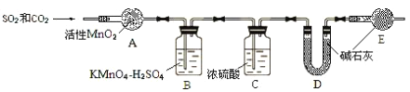
关于下列装置的说法中正确的是
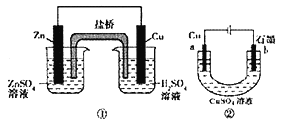
A. 装置①中,盐桥中的K+移向ZnS04溶液
B. 装置②工作一段时间后,加适量的Cu(OH)2可能恢复原溶液浓度
C. 装置②工作一段时间后,b极附近溶液的pH增大
D. 刚开始时装置①②中的溶液内的H+都在铜电极上被还原,有气泡产生
难度: 中等查看答案及解析
-
A、B两种烃,含氢元素的质量分数相等,下列有关A、B的叙述正确的是
A. A和B的分子式一定相等 B. A和B一定是同分异构体
C. A和B可能是同系物 D. 等物质的量的A和B完全燃烧生成水的物质的量一定相等
难度: 简单查看答案及解析