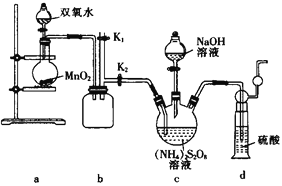
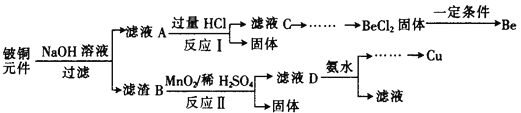
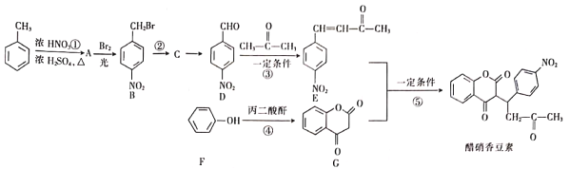
-
下列说法不正确的是( )
A. 硝化甘油在体内能够分解出大量硝酸,会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛
B. 侯氏制碱法的工艺流程应用了物质溶解度的差异
C. 刚玉、红宝石、蓝宝石的主要成分是氧化铝,而青花瓷、玻璃、分子筛的主要成分是硅酸盐
D. 生物炼铜法就是利用某种能耐受铜盐毒性的细菌,利用空气中的氧气把不溶性的硫化铜转化为可溶性的铜盐,从而使铜的冶炼变得成本低,污染小,反应条件十分简单
难度: 中等查看答案及解析
-
下列实验对应的解释或结论正确的是
选项
实验
解释或结论
A
室温下,向含少量FeCl3的CuCl2溶液中加入铜屑,充分搅拌,过滤,得蓝色溶液
除去杂质FeCl3得到纯净的CuCl2溶液
B
向蔗糖中加入浓硫酸,变黑,放热,体积膨胀,放出有刺激性气味的气体
浓硫酸具有脱水性和强氧化性,反应中生成C、SO2和CO2等
C
H2O2、SO2分别加入或通入酸性高锰酸钾溶液,溶液均褪色
前者表现还原性,后者表现漂白性
D
在少量无水乙醇中加入金属钠,缓慢生成可以在空气中燃烧的气体
CH3CH2OH是弱电解质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述错误的是( )
A. 17gH2O2所含非极性键数目为0.5NA
B. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
C. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA
D. 100gCaS和CaSO4的混合物中含有32g硫,则含有的氧原子数为1.75NA
难度: 中等查看答案及解析
-
下列是三种有机物的结构简式,下列说法正确的是( )
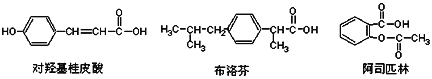
A. 三种有机物都能发生水解反应
B. 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种
C. 三种物质中,其中有两种互为同分异构体
D. 三种物质在一定条件下,均可以被氧化
难度: 中等查看答案及解析
-
短期主族元素A、B、C、D原子序数依次增大。已知:A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是 ( )
A. 原子半径:A<B<C<D
B. B的氧化物是酸性氧化物,可溶于氨水
C. D的最高价氧化物的水化物的酸性大于C的最高价氧化物的水化物的酸性
D. 四氧化三铁与B的反应是工业上大量生产铁的重要方法
难度: 中等查看答案及解析
-
银一 Ferrozine法检测甲醛(HCHO)的原理为①在原电池装置中,氧化银能将甲醛充分氧化为CO2;②Fe3+与产生的Ag定量反应生成Fe2+;③Fe2+与 ferrozine形成有色配合物;④测定溶液的吸光度(吸光度与溶液中有色物质的浓度成正比)。下列说法正确的是
A. ①中,负极的电极反应式为2Ag2O+4H++4e-====4Ag+2H2O
B. ①中,溶液中的H+由正极移向负极
C. 理论上消耗的甲醛与生成的Fe2+的物质的量之比为1:4
D. ④中,甲醛浓度越大,吸光度越小
难度: 中等查看答案及解析
-
在湿法炼锌的电解循环溶液中,较高浓度的
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
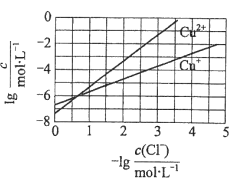
A.
的数量级为
B. 除
反应为Cu+Cu2++2
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
难度: 困难查看答案及解析