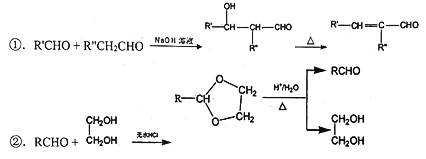
-
化学与生活、社会发展息息相关。下列说法错误的是
A. 用“静电除尘” “燃煤固硫” “汽车尾气催化净化”等方法,可提高空气质量
B. “山东疫苗案”涉及的疫苗因未冷藏储运而失效,这与蛋白质变性有关
C. 2018年11月福建东港石化“碳九”泄露事件引发社会关注。“碳九”通常是指—系列含9个碳原子的碳氢化合物
D. 有人称“一带一路”是“现代丝绸之路”。丝绸的主要成分是纤维素,属于天然高分子化合物
难度: 简单查看答案及解析
-
2018年11月,在法国凡尔赛召开的国际计量大会(CGPM)第26次会议将阿伏加德罗常数的定义修改为“1摩尔包含6.02214076×1023个基本单元,这个常数被称为阿伏加德罗常数,单位为mol-1”。基于这一新定义,阿伏加德罗常数的不确定度被消除了。”新定义将于2019年5月20日正式生效。下列说法错误的是
A. 常温常压下,水蒸气通过过量的Na2O2使其增重2g时,反应中转移的电子数为NA
B. 白磷分子(P4)呈正四面体结构,31g白磷中含P-P键的数目为1.5NA
C. 1.0L0.1mol/LNa2S溶液中含有的S2-数目为0.1NA
D. 4.4gCO2和N2O的混合气体中含有的原子总数为0.3NA
难度: 中等查看答案及解析
-
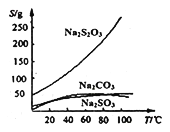
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
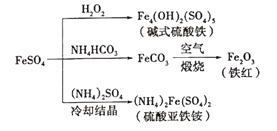
A. 碱式硫酸铁水解能产生Fe(OH)3胶体,可用做净水剂
B. 该温度下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大
C. 可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化
D. 为防止NH4HCO3分解,生产FeCO3需在较低温度下进行
难度: 中等查看答案及解析
-
已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是

A. 原子半径:Z>Y>X
B. X与Y形成的化合物只含极性键
C. Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D. 气态氢化物的稳定性:A<C
难度: 中等查看答案及解析
-
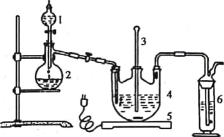
用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
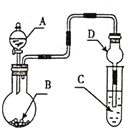
A. 若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B. 实验仪器D可以起到防止溶液倒吸的作用
C. 若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液中先产生白色沉淀,然后沉淀又溶解
D. 若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
难度: 中等查看答案及解析
-
解释下列反应原理的离子方程式正确的是
A. 用加热的方法降低自来水中钙离子浓度:Ca2++2HCO3-
CaCO3↓+H2O+CO2↑
B. 向CH2BrCOOH中加入足量的NaOH溶液并加热:CH2BrCOOH+OH-→CH2BrCOO-+H2O
C. 向Mg(HCO3)2溶液中加入足量的NaOH溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+H2O
D. 在强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
难度: 困难查看答案及解析
-
查阅资料可知,苯可被臭氧氧化,发生如下反应:
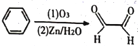 。则二甲苯通过上述反应得到的产物有几种
。则二甲苯通过上述反应得到的产物有几种A. 2 B. 3 C. 4 D. 5
难度: 中等查看答案及解析
-
下列除杂方案错误的是
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
MgO(s)
Al2O3(s)
NaOH溶液
过滤
B
FeCl2(aq)
FeCl3(aq)
Fe屑
过滤
C
C2H2(g)
H2S(g)
CuSO4溶液
洗气
D
NaCl(s)
KNO3(s)
水
蒸发浓缩,冷却结晶,过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
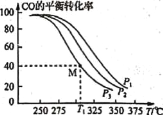
研究表明CO与N2O在Fe+作用下发生反应的能量变化及反应历程如图所示,两步反应分別为:①N2O+Fe+=N2+FeO (慢):②FeO++CO=CO2+Fe+ (快)。下列说法正确的是
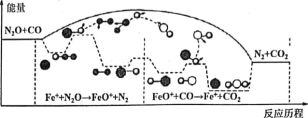
A. 反应①是氧化还原反应,反应②是非氧化还原反应
B. 两步反应均为放热反应,总反应的化学反应速率由反应②决定
C. Fe+使反应的活化能减小,FeO+是中间产物
D. 若转移lmol电子,则消耗II.2LN2O
难度: 中等查看答案及解析
-
铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如下图。若上端开口关闭,可得到强还原性的H•(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的,0H (羟基自由基)。下列说法错误的是
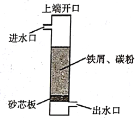
A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e=Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e=H•
C. 鼓入空气时,每生成lmol,OH有2mol电子发生转移
D. 处理含有草酸(H2C204)的污水时,上端开口应打开并鼓入空气
难度: 中等查看答案及解析
-
纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗,其制备过程如图所示,下列叙述不合理的是
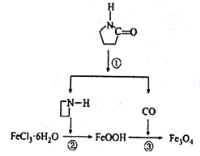
A. 在反应②中,
的作用可能是促进氯化铁水解
B. 直接加热FeCl3溶液也可以得到Fe3O4
C. 反应③的化学方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
D. 纳米四氧化三铁形成的分散系,有可能产生丁达尔效应
难度: 困难查看答案及解析
-
一定温度下,在三个容积相同的恒容密闭容器中按不同的方式投入反应物,发生反应 N2(g)+3H2(g)
2NH3(g) △H=-92.4kJ/mol,测得反应的相关数据如下表:
容器甲
容器乙
容器丙
反应温度/℃
400
400
500
反应物投入量
1molN2,3molH2
4molNH3
1molN2,3molH2
平衡时v(正)(H2)/mol/(L·s)
v1
v2
v3
平衡时c(NH3)/(mol/L)
c1
c2
c3
平衡时总压强P/Pa
P1
P2
P3
物质的平衡转化率a
a1(N2)
a2(NH3)
a3(N2)
平衡常数K
K1
K2
K3
下列关系正确的是
A. v1<v2,c1<2c2 B. c2>2c3,a2(NH3)+a3(N2)<1
C. K1>K3, P2>2P3 D. v1<v3,a1(N2)<a3(N2)
难度: 困难查看答案及解析
-
常温下,用0.l0mol/LKOH溶液滴定10.00mL 0.10mol/LH2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是
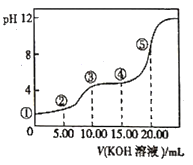
A. 点①所示溶液中
=1012
B. 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C. 点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 点④所示溶液中:c(K+)+ c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.10mol/L
难度: 困难查看答案及解析
-
将一定量的镁和铜组成的混合物加入到足量的稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g。下列叙述错误的是
A. 当金属全部溶解时,电子转移的数目为0.3NA
B. 参加反应的金属的总质量3.6g<w<9.6g
C. 当金属全部溶解时,产生的NO气体的体积在标准状况下为2.24L
D. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积为l00mL
难度: 中等查看答案及解析