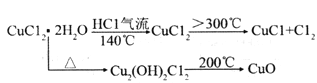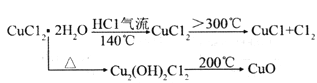-
硒及其化合物在生产、生活中有着广泛的应用,掺杂硒的纳米氧化亚铜常用作光敏材料、电解锰行业催化剂等。
(1)酸性溶液中Na2SO3将H2SeO3和H2SeO4还原为晒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)=Se(s)+2H2SO4(aq) △H1
2H2SeO4(aq)+Se(s)+H2O(l)=3H2SO4(aq) △H2
H2SeO4(aq)+2SO2(g)+2H2O(l)=Se(s)+3H2SO4(aq) △H3
实验中控制其他条件不变(盐酸浓度等), 与硒还原率关系如图1。在A点之前,随着
与硒还原率关系如图1。在A点之前,随着 的增加,Se的还原率不断升高的原因是_____________。
的增加,Se的还原率不断升高的原因是_____________。
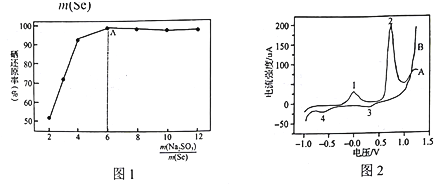
(2)向Na2SeO3溶液中加入适量的AgNO3溶液,得到Ag2Se纳米晶体,同时产生N2。该反应的离子方程式为 ______。
(3)制 PbSe 纳米管时还产生了副产物PbSeO3。己知:Ksp(PbSeO3)=3×l0-12, Ksp(PbSe)= 3×l0-38。为了除去PbSe中混有的PbSeO3,可以采取的措施是______。
(4)实验室测得碱性条件下PbSe纳米管在电极表面的氧化还原行为,结果如图2所示。其中一条曲线上的峰表示氧化过程,另一条曲线上的峰表示还原过程。整个过程共发生如下变化:Pb(OH)2—PbO2;Pb(OH)2—Pb; PbSe—Se; PbO2→Pb(OH)2,各物质均难溶于水。峰1对应的电极反应式为:PbSe-2e-+2OH-=Pb(OH)2+Se;则峰2对应的电极反应式为 ______。
(5)掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:CO(g)+2H2(g) CH3OH(g) △H=akJ/mol。按n(H2):n(CO)=1:1的投料比将H2与CO充入VL的恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如下图所示。
CH3OH(g) △H=akJ/mol。按n(H2):n(CO)=1:1的投料比将H2与CO充入VL的恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如下图所示。
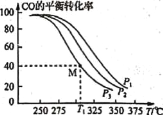
①压强P1、P2、P3由小到大的顺序是 __________。
②T1 ℃时若向该容器中充入2.0 mol H2和2.0 mol CO发生上述反应,5 min后反应达到平衡(M点),则M点对应条件下反应的平衡常数为 ______。
(6)将CuCl水解再热分解可得到纳米Cu2O。CuCl 水解的反应为 CuCl(s) +H2O(1)  CuOH(s)+Cl-(aq)+H+(aq),该反应的平衡常数 K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________。
CuOH(s)+Cl-(aq)+H+(aq),该反应的平衡常数 K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________。
-
(题文)掺杂硒的纳米氧化亚铜常用作光敏材料、能源行业催化剂等。
(1)酸性溶液中Na2SO3将H2SeO2和H2SeO4还原为硒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)=Se(s)+2H2SO4(aq) △H1
2H2SeO4(aq)+Se(s)+H2O(l)=3H2SeO3(aq) △H2
H2SeO4(aq)+3SO2(g)+2H2O(l)=Se(s)+3H2SO4(aq) △H3
则△H2=_____________(用△H1和△H3表示)。
(2)H2S与CO2在纳米Cu2O催化作用下反应可生成羰基硫(COS) ,羰基硫的结构式为____________________。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及溶液中物质的有关转化如图1所示,

①阳极的电极反应式为_________________________。
②电解一段时间后,向电解液中补充一定量的_________________可将溶液恢复至初始状态。
(4)掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)  CH3OH(g) △H=akJ·mol-1。
CH3OH(g) △H=akJ·mol-1。
按 =1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
=1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
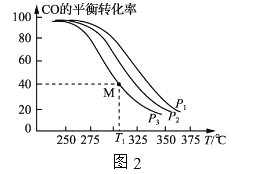
①a_____(填“>”或“<”)0;压强p1、p2、p3由小到大的顺序是___________________。
②T1℃时若向该容器中充入2. 0 mol H2和2.0 molCO发生上述反应,5 min后反应达到平衡(M点),则0~5 min内,v(H2)=____ mol·L-1·min-1,M点对应条件下反应的平衡常数
为________________。
(5)将CuCl水解再热分解可得到纳米Cu2O。CuCl 水解的反应为CuC(s) +H2O(l)  CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________________。
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________________。
-
掺杂硒的纳米氧化亚铜常用作光敏材料、能源行业催化剂等。
(1)酸性溶液中Na2SO3将H2SeO3和H2SeO4还原为硒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)===Se(s)+2H2 SO4(aq) △H1
2H2SeO4(aq)+Se(s)+ H2O (1)===3H2SeO3(ag) △H2
H2SeO4(aq)+ 3SO2(g)+2H2 O(1)===Se(s)+3H2 SO4 (aq) △H3
则△H2=___________(用△H1和△H3表示)。
(2)H2S与CO2在纳米Cu2O催化作用下反应可生成羰基硫(COS),羰基硫的结构式为______________________。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及溶液中物质的有关转化如图1所示。

①阳极的电极反应式为_________________________________。
②电解一段时间后,向电解液中补充一定量的_______________可将溶液恢复至初始状态。
(4)掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g) CH3OH(g) △H=akJ·mol-1。
CH3OH(g) △H=akJ·mol-1。
按 的投料比将H2与CO充人VL的恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
的投料比将H2与CO充人VL的恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。

①a___________(填“>”或”<”)0;压强p1、p2、p 3由小到大的顺序是___________。
②T1℃时,若向该容器中充入2.0mol H2和2.0 mol CO发生上述反应,5min后反应达到平衡(M点),则0~5min内,v(H2)=___________mol·L-1·min-1,N点对应条件下反应的平衡常数为___________。
-
硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:

请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________。
(2)写出步骤③中主要反应的离子方程式:____________________________________。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是__________(写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是_____________。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:_____。
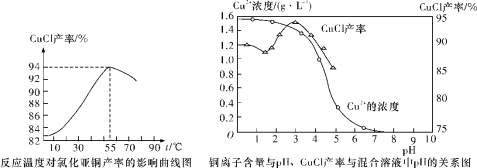
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是____________________________________;温度过高、pH过大也会影响CuCl产率的原因是_______________________________。
(7)用NaHS作污水处理的沉淀剂,可以处理工业废水中的Cu2+。已知:25℃时,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,CuS的溶度积为Ksp(CuS)=6.3×10-36。反应Cu2+(aq)+HS-(aq)  CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
-
铜及其化合物在工农业生产有着重要的用途,氯化铜、氯化业铜经常用作催化剂。其中CuCl广泛应用于化工和印染等行业。
【查阅资料】(i)氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15 -25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100得到无水物。
(ii)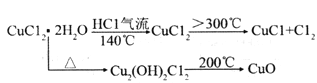
(1)实验室用如图所示的实验仪器及药品制备纯净、干燥的氧气并与铜反应(铁架台,铁夹略) 制备氯化铜。
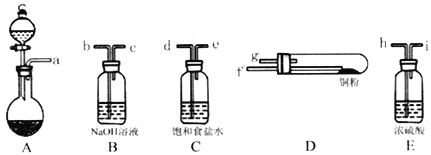
①按气流方向连接各仪器接口顺序是:
a→_____、_____→_____、_____→_____、_____→_____。
②本套装置有两个仪器需要加热,加热的顺序为先_____后_______
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,写出该反应的化学方程式:_____________________。
(3)现欲从(2)所得溶液获得纯净的CuCl2•2H2O,进行如下操作:
①首先向溶液中加入H2O2溶液然后再加试剂X 用于调节pH,过滤,除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3•H2O C.CuO d.CuSO4
②要获得纯净CuCl2•2H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、_____、_____、洗涤、干燥。
(4)用CuCl2•2H2O为原料制备CuCl 时,发现其中含有少量的CuCl 2或CuO杂质,若杂质是CuCl2,则产生的原因是______________。
(5)设计简单的实验验证0.1mol/L 的CuCl2溶液中的Cu2+ 对H2O2的分解具有催化作用:_____。
-
铜及其化合物在工农业生产有着重要的用途,氯化铜、氯化业铜经常用作催化剂。其中CuCl广泛应用于化工和印染等行业。
【查阅资料】(i)氯化铜:从水溶液中结晶时,在15℃以下得到四水物,在15 -25.7℃得到三水物,在26~42℃得到二水物,在42℃以上得到一水物,在100得到无水物。
(ii)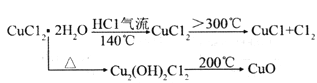
(1)实验室用如图所示的实验仪器及药品制备纯净、干燥的氧气并与铜反应(铁架台,铁夹略) 制备氯化铜。
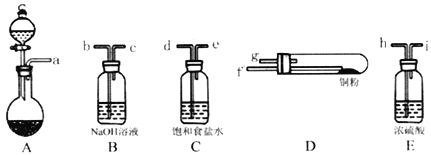
①按气流方向连接各仪器接口顺序是:
a→_____、_____→_____、_____→_____、_____→_____。
②本套装置有两个仪器需要加热,加热的顺序为先_____后_______
(2)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,写出该反应的化学方程式:_____________________。
(3)现欲从(2)所得溶液获得纯净的CuCl2•2H2O,进行如下操作:
①首先向溶液中加入H2O2溶液然后再加试剂X 用于调节pH,过滤,除去杂质,X可选用下列试剂中的(填序号)
a.NaOH b.NH3•H2O C.CuO d.CuSO4
②要获得纯净CuCl2•2H2O晶体的系列操作步骤为:向①所得滤液中加少量盐酸,蒸发浓缩、_____、_____、洗涤、干燥。
(4)用CuCl2•2H2O为原料制备CuCl 时,发现其中含有少量的CuCl 2或CuO杂质,若杂质是CuCl2,则产生的原因是______________。
(5)设计简单的实验验证0.1mol/L 的CuCl2溶液中的Cu2+ 对H2O2的分解具有催化作用:_____。
-
元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。
(1)硒常用作光敏材料,基态硒原子的价电子排布图为__________;与硒同周期的p区元素中第一电离能大于硒的元素有__________种;SeO3的空间构型是_______________。
(2)科学家在研究金属矿物质组分的过程中,发现了Cu—Ni—Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________________________________。
(3)镍能与类卤素(SCN)2反应生成Ni(SCN)2。(SCN)2分子中硫原子的杂化方式是__________________,σ键和π键数目之比为_____________。
(4)Co(NH3)5Cl3是钴的一种配合物,向100mL0.2mol·L-1该配合物的溶液中加入足量AgNO3溶液,生成5.74g白色沉淀,则该配合物的化学式为_____________,中心离子的配位数为________________。
(5)已知:r(Fe2+)为61pm,r(Co2+)为65pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是__________________________________。
(6)某离子型铁的氧化物晶胞如下图所示,它由X、Y组成,则该氧化物的化学式为________________________。已知该晶体的密度为dg·cm-3,阿伏加德罗常数的值为NA,则该品体的晶胞参数a=_______pm(用含d和NA的代数式表示)。
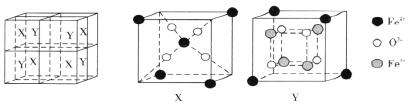
-
据《自然·通讯》(Nature Communications)报道,我国科学家发现了硒化铜纳米催化剂在二氧化碳电化学还原法生产甲醇过程中催化效率高。铜和硒等元素化合物在生产、生活中应用广泛。
请回答下列问题:
(1)基态硒原子的价电子排布式为________;硒所在主族元素的简单氢化物中沸点最低的是________。
(2)电还原法制备甲醇的原理为2CO2+4H2O 2CH3OH+3O2。
2CH3OH+3O2。
①写出该反应中由极性键构成的非极性分子的结构式________;
②标准状况下,V L CO2气体含有________个π键。
(3)苯分子中6个C原子,每个C原子有一个2p轨道参与形成大π键,可记为(π 右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为
右下角“6”表示6个原子,右上角“6”表示6个共用电子)。已知某化合物的结构简式为 ,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
,不能使溴的四氯化碳溶液褪色,由此推知,该分子中存在大π键,可表示为_______,Se的杂化方式为________。
(4)黄铜矿由Cu+、Fe3+、S2-构成,其四方晶系晶胞结构如图所示。则Cu+的配位数为________;若晶胞参数a=b=524pm,c=1032pm,用NA表示阿伏加德罗常数的值,该晶系晶体的密度是________g·cm-3(不必计算或化简,列出计算式即可)。
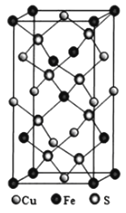
-
(12分)纳米级四氧化三铁是应用最为广泛的软磁性材料之一,常用作记录材料,磁流体材料,催化剂,电子材料等。其在生物技术领域和医学领域也有很好的应用前景。共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示:
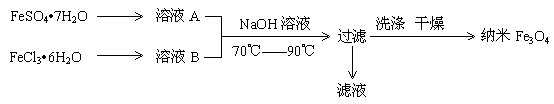
请回答下列问题:(1)实验室保存溶液A时,需加入。
(2)为了得到较纯的纳米Fe3O4,FeSO4·7H2O 和 FeCl3·6H2O的物质的量之比最好应为,在此条件下,检验铁元素是否沉淀完全的实验操作是。
(3)写出制备纳米Fe3O4的离子反应方程式。
(4)共沉淀法的主要不足是:①得到的Fe3O4纳米粒子间存在团聚现象
②。
(5)磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,下列关于纳米Fe3O4磁硫体的说法中不正确的是:。
A、纳米Fe3O4磁硫体分散系属于溶液。
B、纳米Fe3O4磁硫体可以通过渗析法得到提纯。
C、当一束可见光通过该磁硫体时会出现光亮的通路。
D、纳米Fe3O4磁硫体比较稳定。
-
铁及其化合物在日常生活中应用广泛,请回答下列问题:
(1)Fe(NO3)3·9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂,工业上用细铁屑与稀硝酸反应制备,主要流程如下:
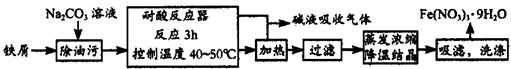
①Na2CO3溶液可以除油污,原因是(用离子方程式表示)_________________________;
②耐腐反应器中可以观察到如下的现象:铁屑__________,溶液颜色变为__________,有______色气体产生;制备过程中需控制加入铁屑的量,当观察到_______________的现象时应停止加入铁屑;
③制得的Fe(NO3)3·9H2O用20% HNO3洗涤,其原因是_________________________。
④若在实验中进行蒸发浓缩、降温结晶的操作,除带铁圈的铁架台、坩埚钳外,还需要的主要仪器有___________。
(2)某兴趣小组在实验室用细铁屑和稀硝酸制备Fe(NO3)3,装置如右图所示(固定所用仪器和加热装置未画出)。
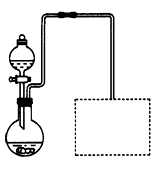
①该实验中对圆底烧瓶加热的最佳方式用__________加热;
②装置中圆底烧瓶上方长导管的作用是_________________;
③请在图中虚线框内画出防止倒吸的尾气吸收装置。(提示:碱液可快速、充分吸收产生的氮的氧化物气体)
与硒还原率关系如图1。在A点之前,随着
的增加,Se的还原率不断升高的原因是_____________。

CH3OH(g) △H=akJ/mol。按n(H2):n(CO)=1:1的投料比将H2与CO充入VL的恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如下图所示。

CuOH(s)+Cl-(aq)+H+(aq),该反应的平衡常数 K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=________。