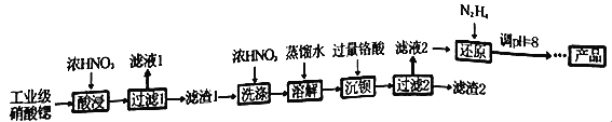
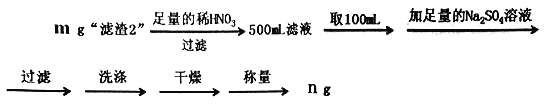
-
化学与科学、技术、社会、环境密切相关,下列说法错误的是
A. 氢氧化铁胶体、淀粉溶液均具有丁达尔效应
B. 化学是一门具有创造性的科学,化学变化的特征是制造新的分子和原子
C. 煤的气化、煤的液化、石油的裂化和重整均属于化学变化
D. “榆荚只能随柳絮,等闲撩乱走空园”中“柳絮”的主要成分是纤维素
难度: 简单查看答案及解析
-
有机物R的结构简式如图所示.下列有关R的性质叙述正确的是
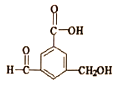
A. R的所有原子一定在同一平面上
B. 在Ni催化和加热条件下,1mol R能与5molH2发生加成反应
C. R既能与羧酸、醇反应,还能发生加成、氧化反应
D. 1mol R与足量氢氧化钠溶液反应,消耗氢氧化钠的物质的量为2mol
难度: 中等查看答案及解析
-
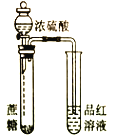
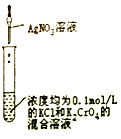
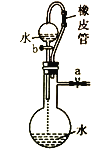
下列有关实验装置、操作,不能实现相应实验目的的是
A
B
C
D
装置
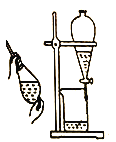
目的
用KOH溶液除去溴苯中单质溴
证明浓硫酸有脱水性、强氧化性
先出现白色沉淀,后出现砖红色沉淀,证明Ksp(AgCl)< Ksp(Ag2CrO4)
不能通过观察水能否全部流下来判断装置气密性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的值,下列说法正确的是
A. 9NA个氢氧根离子和10NA个羟基所含电子数相等
B. 1mol苯乙烯中含碳碳双键数目为4NA
C. 1molC2H5OH和1 mol CH3CO18OH发生酯化反应生成的水分子中含中子数为10NA
D. 粗铜精炼实验中阳极质量减少6.4g,电解过程中转移电子数为0.2NA
难度: 中等查看答案及解析
-
如图是某元素的价类二维图,其中A为正盐,X是一种强碱,通常条件下Z是无色液体,E的相对分子质量比D大16,各物质的转化关系如图所示。下列说法错误的是
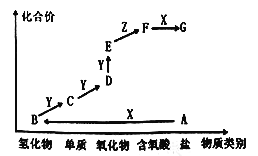
A. A作肥料时不适合与草木灰混合施用
B. 同主族元素的氢化物中B的沸点最低
C. C一般用排水法收集
D. D→E的反应可用于检验D
难度: 中等查看答案及解析
-
电致变色玻璃以其优异的性能将成为市场的新宠,如图所示五层膜的玻璃电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和 Li4 Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是
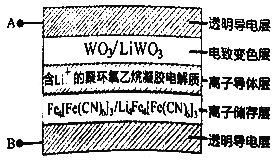
A. 当A外接电源负极时,此时Li+得到电子被还原
B. 当A外接电源正极时,膜的透射率降低,可以有效阻挡阳光
C. 当B外接电源正极时,离子导体层中Li+向下迁移
D. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4e-=Li4Fea[Fe(CN)6]3
难度: 中等查看答案及解析
-
已知:pOH=-lgc(OH-),温度为T℃时,向20.00mL 0.01mol·L-1氨水中滴入0.10mol·L-1的盐酸(不考虑溶质挥发),溶液的pH和pOH与加入盐酸体积关系如图所示。下列说法正确的是
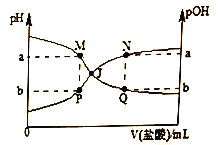
A. 曲线PJN表示溶液中pH的变化
B. 若M点水的电离程度与Q点相等,则Q点一定符合c(Cl-)>c(NH4+)+c(NH3·H2O)
C. M、P两点的数值之和a+b=14
D. pH与pOH交叉点J对应的V(盐酸)=20.00mL
难度: 困难查看答案及解析