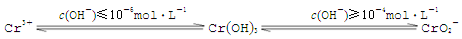-
汽车尾气的主要成分有CO、SO2、氮氧化物等,科学家们-直致力于污染物的有效消除。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
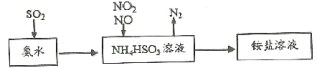
请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_________________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①己知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ· mol-1
2SO2(g)+O2(g)=2SO3(l) △H2=-288.4kJ· mol-1
N2(g)+O2(g) 2NO(g) △H3=+180.5kJ· mol-1
2NO(g) △H3=+180.5kJ· mol-1
请判断反应NO2(g)+SO2(g)=NO(g)+SO3(l) △H4,在低温下能否自发进行_______(填“能”或“否”),理由是__________________________。
②己知TiO2催化尾气降解原理为:
2CO(g)+O2(g) 2CO2(g);2H2O(g)+4NO(g)+3O2(g)
2CO2(g);2H2O(g)+4NO(g)+3O2(g) 4HNO3(g)
4HNO3(g)
i、在一定条件下,模拟CO、NO的降解,得到降解率(即转化率)随时间变化如图所示,
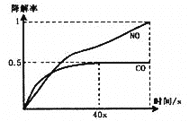
反应40秒后检测到混合气体中N2浓度上升,HNO3气体浓度有所降低,请用化学方程式并结合化学反应原理知识解释可能的原因____________________________________________。
ii,沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合图表回答下列问题:
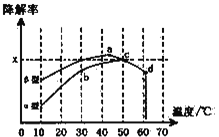
已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________(用含x的代数式表示);以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10~60℃范围内进行实验,请在图中用线段与阴影,仿照“示例”描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(示例: )_____________________。
)_____________________。
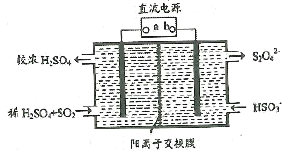
(3)利用如图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2,b极的电极反应式为_______________________________。
-
汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
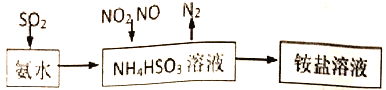
①25℃时,在pH=5的 NH4HSO3溶液中,c(SO32-)+c(NH3·H2O)-c(H2SO3)=__________mol/L(填确值)
②请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_____________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ·mol-1
3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ·mol-1
TiO2催化尾气降解原理可表示为:2COg)+O2(g) 2CO2(g) △H3
2CO2(g) △H3
则2H2O(g)+4NO(g)+3O2(g) 4HNO3(g) △H4=______________________。
4HNO3(g) △H4=______________________。
②在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图1所示。请解释T1后NO降解率下降的可能原因______________________。
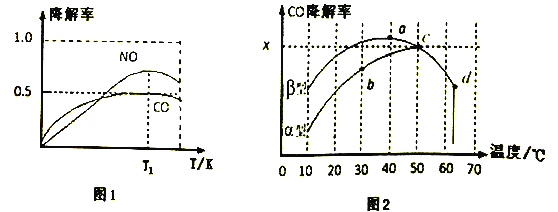
(3)沥青混凝土也可降解CO。如图2为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________________________________。(用含x的代数式表示)
②科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“ ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式____________________________________________。
-
汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、NO2吸收,原理如下图所示。
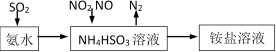
请写出NO2被吸收反应的离子方程式___________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:反应Ⅰ:2NO(g)+O2(g)==2NO2(g) ΔH1 =—113.0 kJ·molˉ1
反应Ⅱ:2SO2(g)+O2(g)==2SO3(1) ΔH2 =—288.4 kJ·molˉ1
反应Ⅲ:3NO2(g)+H2O(g)==2HNO3+NO(g) ΔH3 =—138.0 kJ·molˉ1
则反应NO2(g)+SO2(g)==NO(g)+SO3(1) ΔH4= _______________。
②已知TiO2催化尾气降解原理可表示为:2CO(g)+O2(g)  2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g)
2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g)  4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图所示。请解释ts后NO降解率下降的可能原因_____________________。

(3)沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L—1,求此温度下CO降解反应的平衡常数_______________。
②下列关于如图的叙述正确的是_________________
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“ ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式 ____________________。
-
环境污染中除了有害气体产生的空气污染外,重金属离子在溶液中引起的水体污染也相当严重.近年来城市汽车拥有量呈较快增长趋势,汽车尾气的主要有害成分一氧化碳和氮氧化物加重了城市空气污染.研究NO2、SO2、CO等大气污染气体的处理及研究重金属离子水污染的处理具有非常重要的意义.
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体.将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,若测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K= .
(2)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例).
已知:NO不能与Na2CO3溶液反应.
NO+NO2+Na2CO3=2NaNO2+CO2;2NO2+Na2CO3=NaNO2+NaNO3+CO2
用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为 .
(3)如图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质.A为电池的 极(选填“正”或“负”).写出B极电极反应式 .
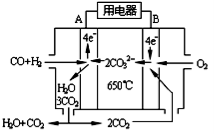
 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
已知: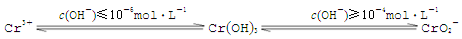
在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.用离子方程式表示溶液pH不能超过10的原因 .
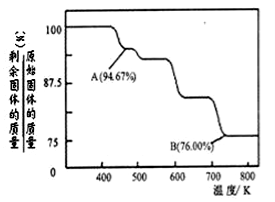
(5)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示.则B点时剩余固体的成分是 (填化学式).
-
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
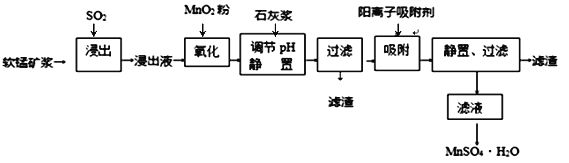
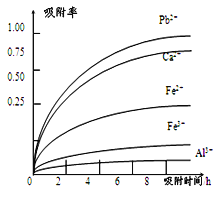
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。

(1)浸出过程中生成Mn2+反应的化学方程式为_________________________________,
(2)Fe2+被氧化的过程中主要反应的离子方程式___________________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有__________________________等(写二点)。
(5)吸附步骤除去的主要离子为_________________。
(6)电解MnSO4、ZnSO4和H2SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式_____。
(7)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是____。
-
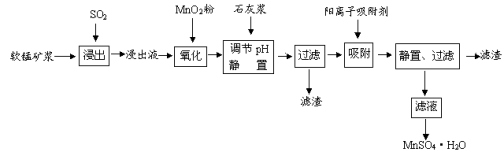
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 | 离子半径(pm) | 开始沉淀 时的pH | 完全沉淀 时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
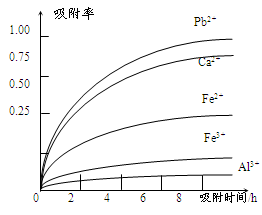
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
-
(15分)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。某校化学兴趣小组的同学为确定该方法所得固体的成分,称取该固体四份,溶于水后,分别逐滴加入相同浓度的硫酸溶液50 mL,产生SO2的体积(标准状况)如下表(实验时设法使水中溶解的SO2几乎完全逸出):
| 实验组别 | ① | ② | ③ | ④ |
| 硫酸溶液的体积(mL) | 50 | 50 | 50 | 50 |
| 盐的质量(g) | 9.260 | 13.890 | 20.835 | 32.410 |
| 二氧化硫的体积(mL) | 1344 | 2016 | 3024 | 2464 |
⑴上述四组实验中,SO2体积与固体的质量之比相同的组别有__________________;由第①组实验中的SO2体积与固体的质量之比,可以推算用6.945 g该固体进行同样的实验时,产生SO2_________mL(标准状况);根据表中________两组数据变化可确认该固体中一定含有(NH4)2SO3。
⑵另取9.260 g该固体与足量的熟石灰共热,收集到标准状况的氨气的体积为3136 mL,则该固体的成分除(NH4)2SO3外还有___________(填化学式),该实验中使用的硫酸的物质的量浓度为_______________。
-
利用废碱渣(主要成分是Na2CO3)处理硫酸厂尾气中的SO2可制得无水Na2SO3(成品),其流程如下:
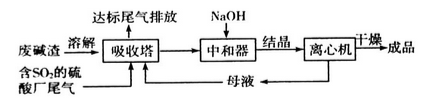
(1)若欲利用废碱渣充分吸收SO2,则“吸收塔”内发生的主要反应的离子方程式为___________________。
(2)处理过程中,要通过检验“吸收塔”排放出的尾气是否含有SO2来确定其是否达标。实验室中欲模拟检验尾气中的SO2,可以选用的试剂有___________________;
a.澄清石灰水 b.硝酸酸化的Ba(NO3)2溶液 c.盐酸酸化的BaCl2溶液 d.品红溶液
(3)常温下,向“中和器”中加入适量NaOH后,溶液呈中性,则溶液中c(SO32-):c(HSO3-)=_____[已知:常温下,Ka1(H2SO3) = l. 5×10-2,Ka2(H2SO3) =6.3×10-8];
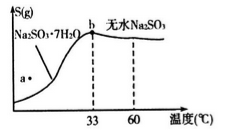
(4)下图所示为亚硫酸钠的溶解度曲线,则上述流程中的“结晶”方法是____________(填“蒸发结晶”或“降温结晶”),图中a点所示分散系类别为_________________;
(5)仅用BaCl2和H2O2的混合溶液难以检出“成品"中的SO32-,原因是“成品”中含有某种杂质阴离子,该杂质阴离子_____________(填化学式);实验室中常用如下方法检验SO32-:

己知25℃时,部分钡盐的数值如下表:
| BaCO3 | BaSO4 | BaSO3 | BaS2O3 |
| 5.1×10-9 | 1.1×10-10 | 8.4×10-7 | 1.6×10-5 |
若“溶液A”中SO32-浓度为0.01 mol·L-1,且为杂质阴离子浓度的10倍,则向其中加入等体积0.01 mol • L-1BaCl2溶液充分反应后c(Ba2+)=________mol·L-1,向 “溶液B”中滴入BaCl2和H2O2的混合溶液时,发生反应的离子方程式为______________。
-
工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气.某校化学兴趣小组的同学为确定该方法所得固体的成分,称取该固体四份,溶于水后,分别逐滴加入相同浓度的硫酸溶液50mL,产生SO2的体积(标准状况)如下表(实验时设法使水中溶解的SO2几乎完全逸出):
| 实验组别 | ① | ② | ③ | ④ |
| 硫酸溶液的体积(mL) | 50 | 50 | 50 | 50 |
| 盐的质量(g) | 9.260 | 13.890 | 20.835 | 32.410 |
| 二氧化硫的体积(mL) | 1344 | 2016 | 3024 | 2464 |
(1)上述四组实验中,SO2体积与固体的质量之比相同的组别有______;由第①组实验中的SO2体积与固体的质量之比,可以推算用6.945g该固体进行同样的实验时,产生SO2______mL(标准状况);根据表中______两组数据变化可确认该固体中一定含有(NH4)2SO3.
(2)另取9.260g该固体与足量的熟石灰共热,收集到标准状况的氨气的体积为3136mL,则该固体的成分除(NH4)2SO3外还有______(填化学式),该实验中使用的硫酸的物质的量浓度为______.
-
[化学——选修2:化学与技术]
研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:
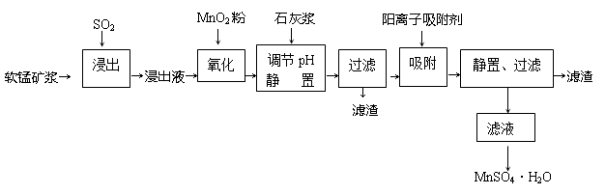
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。
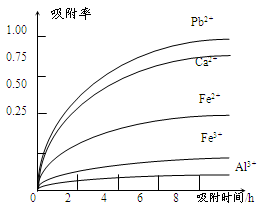
有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图
| 离子 | 离子半径 (pm) | 开始沉淀时 的pH | 完全沉淀时 的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
(1)浸出过程中生成Mn2+反应的化学方程式为___________________________,
(2)Fe2+被氧化的过程中主要反应的离子方程式_________________________。
(3)在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至_______________范围。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有______________________等(写二点)。
(5)吸附步骤除去的主要离子为___________________________。
(6)电解MnSO4 、ZnSO4和H4SO4的混合溶液可制备MnO2和Zn,写出阳极的电极反应方程式_______________。

2CO2(g) △H3
4HNO3(g) △H4=______________________。

”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________







 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.