-
化学与生活密切相关。下列说法错误的是
A. 泡沫灭火器可用于一般的起火,也适用于电器起火
B. 疫苗一般应冷藏存放,以避免蛋白质变性
C. 家庭装修时用水性漆替代传统的油性漆,有利于健康及环境
D. 电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
阿伏加德罗常数的值为
。下列说法正确的是
A. 1L0.1mol·
NH4Cl溶液中,
的数量为0.1
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2
难度: 困难查看答案及解析
-
短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是
W
X
Y
Z
A. 氢化物沸点:W<Z B. 氧化物对应水化物的酸性:Y>W
C. 化合物熔点:Y2X3<YZ3 D. 简单离子的半径:Y<X
难度: 中等查看答案及解析
-
增塑剂DCHP可由环己醇制得。DCHP和环己醇的结构简式如图所示,下列说法错误的是( )
环己醇
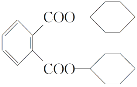
DCHP
A. DCHP的分子式为C20H26O4
B. 环己醇分子中所有碳原子不可能共平面
C. DCHP的一氯取代物有5种
D. DCHP通过取代反应可以得到环己醇
难度: 中等查看答案及解析
-
下列实验操作、现象与结论对应关系正确的是
选项
实验操作
实验现象
结论或解释
A
向盛有漂白粉溶液的试管中加入浓硫酸
产生黄绿色气体
浓硫酸具有氧化性
B
向SO2 水溶液中滴入几滴BaCl2溶液,振荡
出现白色沉淀
此沉淀是BaSO3
C
使装有NO2 气体的密闭容器减小体积
气体颜色先变深而后变浅
气体颜色变浅的原因是2NO2 =N2O4 正向移动
D
先向2mL 0.1mol/L Na2S 溶液中滴入几滴 0.1mol/L ZnSO4 溶液,再加入几滴CuSO4溶液
开始有白色沉淀生成;后又有黑色沉淀生成
溶度积Ksp:ZnS>CuS
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH·H2O]=1.6×10-4]。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
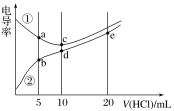
A. d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
B. a点溶液中:c[(CH3)2NH2+]>c[(CH3)2NH·H2O]
C. 曲线①代表滴定二甲胺溶液的曲线
D. b、c、e三点的溶液中,水的电离程度最大的是b点
难度: 中等查看答案及解析
-
电浮选凝聚法处理酸性污水的工作原理如图所示。下列说法不正确的是( )
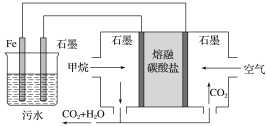
A. 铁电极的电极反应式为Fe-2e-===Fe2+
B. 若左池石墨电极产生44.8 L(标准状况)气体,则消耗1.0 mol甲烷
C. 通入甲烷的石墨电极的电极反应式为CH4+4CO32--8e-===5CO2+2H2O
D. 为了增强污水的导电能力,可向污水中加入适量工业用食盐
难度: 中等查看答案及解析
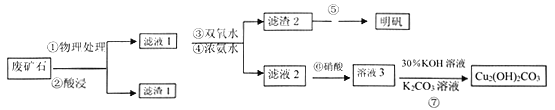
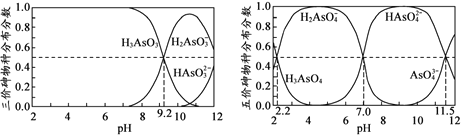
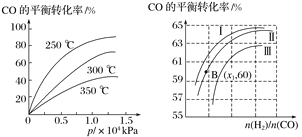
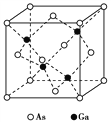
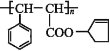 ,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。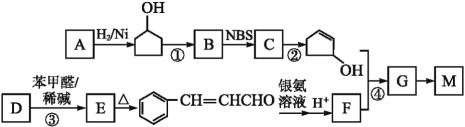
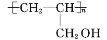 )。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示_____________________。 B……
B……