-
下列说法正确的是
A. 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可加快产生氢气的速率
B. 对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率
C. 将铜片放入稀硫酸中,无明显现象;若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气产生
D. 100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
难度: 简单查看答案及解析
-
苏轼的《格物粗谈》有这样的记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指( )
A. 脱落酸 B. 乙烯 C. 生长素 D. 甲烷
难度: 简单查看答案及解析
-
下列关于电解质的说法,正确的是
A. 金属导电,属于电解质
B. 乙酸是有机物,属于非电解质
C. 只有在水溶液中能够导电的物质才属于电解质
D. NaCl和Al2O3在熔融状态下均导电,都属于电解质
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A. 质子数和中子数均为6的碳原子:
B. 硫离子的结构示意图:
C. 氢氧化钠的电子式:
D. 乙烯的结构简式:CH2CH2
难度: 简单查看答案及解析
-
下列互为同素异形体的是
A. H2O与H2O2 B.
与
C. 石墨与金刚石 D. 正丁烷与异丁烷
难度: 简单查看答案及解析
-
下列变化过程中,ΔS<0的是
A. 氯化钠溶于水中 B. NH3(g)与HCl(g)反应生成NH4Cl(s)
C. 汽油的燃烧 D. 煅烧石灰石得到生石灰和二氧化碳
难度: 中等查看答案及解析
-
根据所学习的电化学知识,下列说法正确的是
A. 太阳能电池的主要材料为二氧化硅
B. 铁与电源正极连接可实现电化学保护
C. 酸雨后钢铁易发生析氢腐蚀、铁锅存留盐液时易发生吸氧腐蚀
D. iPhone7s用的锂离子电池属于一次电池
难度: 困难查看答案及解析
-
从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸中呈现红色,在NaOH溶液中呈现蓝色,将HR加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测
A. HR应为红色 B. HR应为蓝色 C. R-应为无色 D. R-应为红色
难度: 中等查看答案及解析
-
对下列各种溶液中所含离子的判断合理的是
A. 向无色溶液中加氯水变橙色,溶液中可能含: SO42-、Br-、OH-、Ba2+
B. 25℃时在水电离出的c(H+)=1.0×10-11mol/L的溶液中可能含:Mg2+、Cu2+、SO42-、NO3-
C. 某溶液,加铝粉有氢气放出,则溶液中可能含:K+、Na+、H+、NO3-
D. 在c(Fe3+)=1.0 mol/L的溶液中可能含:K+、Na+、SCN-、HCO3-
难度: 困难查看答案及解析
-
①pH=0的盐酸 ②0.5 mol·L-1的盐酸 ③0.1 mol·L-1的NH4Cl溶液 ④0.1 mol·L-1的NaOH溶液 ⑤0.5 mol·L-1的NH4Cl溶液,以上溶液中水电离出的c(H+)由大到小的顺序是
A. ⑤③④②① B. ①②③⑤④ C. ①②③④⑤ D. ⑤③④①②
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,6.4 g O2和O3的混合气体中含有的原子数为0.4NA
B. 100 mL l mol·L-1的碳酸钠溶液中含有的CO32-数为0.1NA
C. 标准状况下,2.24 L苯中含有的碳原子数为0.6NA
D. 用含有少量锌、铁、银等杂质的粗铜作阳极电解精炼铜,当阴极析出64 g金属时,阳极失去的电子数小于2NA
难度: 困难查看答案及解析
-
下列说法中,不正确的是
A. 用惰性电极电解饱和食盐水或熔融氯化钠时,阳极的电极反应式均为2Cl--2e-===Cl2↑
B. 酸性介质或碱性介质的氢氧燃料电池的正极反应式均为O2+2H2O+4e-===4OH-
C. 精炼铜和电镀铜时,与电源负极相连的电极反应式均为Cu2++2e-===Cu
D. 钢铁发生吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-===Fe2+
难度: 中等查看答案及解析
-
下列实验误差分析不正确的是
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度差值△t偏小
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A. 实验室中常用排饱和食盐水的方法收集Cl2
B. 对CO(g)+NO2(g)
CO2(g)+NO(g),平衡体系增大压强可使颜色变深
C. 升高温度能够促进水的电离
D. 在含有Fe(SCN)3的红色溶液中加少量铁粉,振荡静置,溶液颜色变浅
难度: 中等查看答案及解析
-
下列图中,表示2A(g)+B(g)⇌ 2C(g) ΔH<0可逆反应的图像为
A.
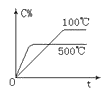 B.
B. 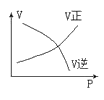
C.
 D.
D. 
难度: 中等查看答案及解析
-
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol—1、P—O bkJ·mol—1、P="O" ckJ·mol—1、O="O " dkJ·mol—1。
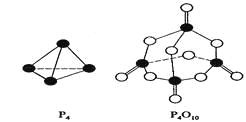
根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
A. (6a+5d-4c-12b)kJ·mol—1B(4c+12b-6a-5d)kJ·mol—1 B. (4c+12b-4a-5d)kJ·mol—1
C. (4a+5d-4c-12b)kJ·mol—1
难度: 中等查看答案及解析
-
根据下图回答,下列说法不正确的是
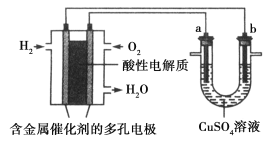
A. 此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变
B. 燃料电池中正极反应为O2+4e−+4H+===2H2O
C. 电子经导线流入a电极
D. 若a为粗铜,b为纯铜,该装置可用于粗铜的精炼
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A. CH3—CH=CH2和CH2=CH2的最简式相同
B.
与
互为同系物
C. 下列物质的沸点按由低到高顺序为:(CH3) 2CHCH3<(CH3) 4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3
D. 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小
难度: 简单查看答案及解析
-
某有机物A质谱图、核磁共振氢谱图如下,则A的结构简式可能为

A. HCOOH B. CH3CHO C. CH3CH2OH D. CH3CH2CH2COOH
难度: 困难查看答案及解析
-
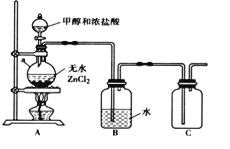
下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
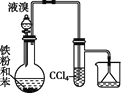
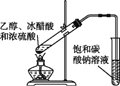
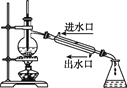

A.实验室制取溴苯
B.实验室制取乙酸乙酯
C.石油分馏
D.实验室制取硝基苯
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
现有乙酸和两种链状单烯烃及甲酸乙酯的混合物,其中氧的质量分数为a,则碳的质量分数
A.
B.
C.
D.
难度: 困难查看答案及解析
-
组成和结构可用
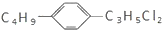 表示的有机物(不考虑立体结构)共有
表示的有机物(不考虑立体结构)共有A. 24种 B. 28种 C. 32种 D. 36种
难度: 简单查看答案及解析
-
已知:pKa=-lgKa,25℃时,H2A 的 pKa1=1.85,pKa2=7.19。常温下,用 0.1 mol/LNaOH 溶液滴定20 mL 0.1 mol/LH2A 溶液的滴定曲线如图所示。下列说法正确的是
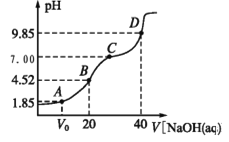
A. A 点所得溶液中:V0<10 mL
B. B 点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C. C 点所得溶液中:c(A2-)= c(Na+)-c(HA-)-c(H2A)
D. D 点所得溶液中 A2-水解平衡常数 Kh1=10-7.19
难度: 困难查看答案及解析
-
下列实验过程可以达到实验目的的是
选项
实验目的
实验过程
A.
比较碳酸和醋酸的酸性
常温下,用pH计测量等浓度醋酸钠和碳酸氢钠溶液的pH
B.
探究浓度对反应速率的影响
向盛有4mL浓度分别为0.01mol/L和0.05mol/LKMnO4酸性溶液的两支试管中,同时加入4mL0.1mol/L的草酸溶液,记录褪色所需时间
C.
证明Ksp[Fe(OH)3]<Ksp[Al (OH)3]
向1mL0.1 mol·L-1NaOH溶液中滴加2滴0.1 mol·L-1 AlCl3溶液,充分反应后再滴加2滴0.1 mol·L-1 FeCl3溶液,观察沉淀颜色变化
D.
探究温度对反应速率的影响
将2支盛有5 mL同浓度NaHSO3溶液的试管和两支盛有2 mL 5%H2O2溶液的试管分成两组,一组放入冷水中,另一组放入热水中,经过一段时间分别混合并搅拌,观察实验现象
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,ʋ正,ʋ逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
难度: 困难查看答案及解析