-
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下Al2O3(s)+AlCl3(g)+3C(s) =3AlCl (g)+3CO(g) △H = a kJ·mol-1
3AlCl(g)=2Al(l)+ AlCl3 (g) △H = b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H=________kJ·mol-1(用含a、b的代数式表示)。
②Al4C3也是该反应过程中的一种中间产物。Al4C3 与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为_______________。
③甲烷和水反应可以制水煤气(混合气体),在恒温、固定体积为V升的密闭容器中的反应微观示意图如下所示,根据微观示意图得出的结论中,正确的是_____________。
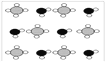
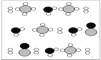
一定条件下经过t分钟达到化学平衡
a. 该反应方程式为:CH4+H2O = CO+3H2
b. 该反应平衡前后压强比为3:4
c. 该反应体系中含氢元素的化合物有3种
d. 该反应中甲烷的平衡转化率为50%
④水煤气中的H2可用于生产NH3,在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收其中的CO,防止合成塔中的催化剂中毒,其反应是:
[Cu(NH3)2]Ac(aq) + CO(g) + NH3(g)  [Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)3]Ac·CO(aq) △H<0
[Cu(NH3)2]Ac溶液吸收CO的适宜生产条件应是____________________。该条件下用气体表示的平衡常数表达式为:K=______________
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,一般在氩气环境中将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下可完全吸氢得到的混合物Y(含MgH2 和Al),Y在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是_________________。
②写出镁铝合金(Mg17Al12 ) 在一定条件下完全吸氢的化学方程式 _________________。
③在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为_________。
-
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原一氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH=a kJ·mol−1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol−1
①反应Al2O3(s)+3C(s)===2Al(l)+3CO(g)的ΔH=________kJ·mol−1(用含a、b的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为:_____________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是____________________________。
②在6.0mol·L−1 HCl溶液中,混合物Y能完全释放出H2。1mol Mg17Al12完全吸氢后得到的混合物Y与上述足量盐酸完全反应,释放出H2的物质的量为__________________。
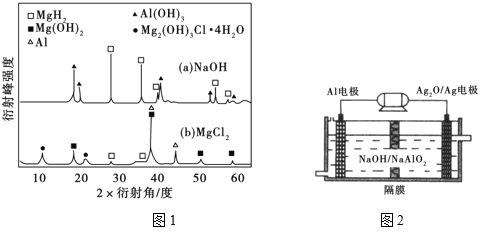
③在0.5mol·L−1 NaOH和1.0mol·L−1 MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图1所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH溶液中,混合物Y中产生氢气的主要物质是_______________ (填化学式)。
(3)铝电池性能优越,Al-Ag2O电池可用作水下动力电源,其原理如图2所示。该电池负极反应式为______________________________________。
-
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol﹣1
3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ•mol﹣1
①反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H= kJ•mol﹣1(用含a、b的代数式表示).
②Al4C3是反应过程中的中间产物.Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为 .
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得.该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2═17MgH2+12Al.得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气.
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 .
②在6.0mol•L﹣1HCl溶液中,混合物Y能完全释放出H2.1mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为 .
③在0.5 mol•L﹣1NaOH和1.0 mol•L﹣1MgCl2溶液中,混合物Y均只能部分放出氢气,反应后残留固体物质X﹣射线衍射谱图如下图所示(X﹣射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).在上述NaOH溶液中,混合物Y中产生氢气的主要物质是 (填化学式).
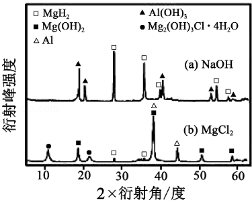
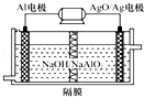
(3)铝电池性能优越,Al﹣AgO电池可用作水下动力电源,其原理如右下图(图2)所示.该电池反应的化学方程式为: .
-
铝是地壳中含量最高的金属元素,其单质及化合物在生产生活中有广泛的应用。
(1)普通水泥的主要成分之一是铝酸三钙(3CaO·Al2O3),3CaO·Al2O3中Al的化合价为__________;
(2)氯化铝广泛用于有机合成和石油工业的催化剂。将铝土矿粉(Al2O3)与炭粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式__________;
(3)现将一定量的铝粉和镁粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐渐加入4mol·L-1的NaOH溶液,加入NaOH溶液的体积(mL)与产生沉淀的质量的关系如图所示。
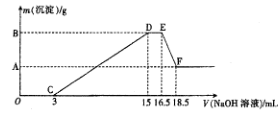
①D→E过程中反应的离子方程式为____________________;
②A点对应纵坐标的数值是__________,原稀硝酸的浓度是__________mol·L-1。
-
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)═3AlCl(g)+3CO(g)△H=a kJ•mol-1
3AlCl(g)═2Al(l)+AlCl3(g)△H=b kJ•mol-1
①反应Al2O3(s)+3C(s)═2Al(l)+3CO(g)的△H=______kJ•mol-1(用含a、b的代数式表示).
②Al4C3是反应过程中的中间产物.Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为______.
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39kJ•mol-1
2H2O2(aq)═2H2O(l)+O2(g)△H=-196.46kJ•mol-1
H2(g)+ O2(g)═H2O(l)△H=-285.84kJ•mol-1
O2(g)═H2O(l)△H=-285.84kJ•mol-1
则H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为______.
-
真空碳热还原—氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s) 3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g) 2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
反应Al2O3(s) +3C(s) 2Al(l)+3CO(g)的ΔH= kJ·mol-1(用含a、b的代数式表示)。
2Al(l)+3CO(g)的ΔH= kJ·mol-1(用含a、b的代数式表示)。
-
铝元素含量居金属首位, 主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ、工业上用铝土矿制备铝的某种化合物的工艺流程如下:
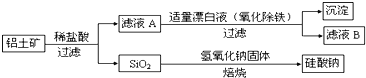
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:
Fe2++□ClO-+□________________________ ________________________═□Fe(OH)3↓+□Cl-+□__________
②检验滤液B中是否还含有铁元素的方法为:_________________________
③将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为__________(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
④由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、__________(填操作名称)、过滤、洗涤。
Ⅱ、明矾(KAl(SO4)2·12H2O)在日常生活、生产中也占有一席之地。
(1)明矾曾经是净水明星,用离子方程式表示其净水原理_____________________________。
(2)明矾净水时,若不慎过量会有一定程度的副作用。将含有明矾的水溶液中加入Ba(OH)2溶液至铝离子恰好完全沉淀,并且过滤,就可以避免,请用离子反方程式描述其过程______________。
-
铝元素含量居金属首位,主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。铝的单质及其化合物在生产、生活、科研等领城应用广泛。
Ⅰ.工业上用铝土矿制备铝的某种化合物的工艺流程如图:
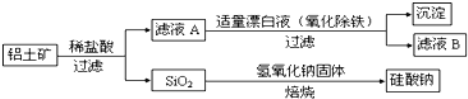
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①该过程中涉及某氧化还原反应如下,请完成:___Fe2++___ClO-+___=___Fe(OH)3↓+___C1-+___
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为___(选填代号)
A.氢氧化钠溶液 B.硫酸溶液 C.氨水 D.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、___(填操作名称)、过滤、洗涤。
Ⅱ.铵明矾(NH4Al(SO4)2•12H2O)是常见的食品添加剂,在日常生活、生产中也占有一席之地。
(1)铵明矾可用于净水,用离子方程式表示其净水原理___;向其溶液中逐滴加入NaOH溶液至过量,可观察到的现象是___。
(2)实验证明铵明矾高温分解后气体的组成成份是NH3、N2、SO3、SO2和H2O,且相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=___。
(3)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为___(填代号)。
-
(10分)碳、氮和铝的单质及其化合物在工农业生产和生活中有重要作用。
(1)真空碳热还原氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+ 2AlCl3(g)+ 6C(s)=6AlCl(g)+ 6CO(g) △H=a kJ•mol-1
②3AlCl(g)= 2Al(l)+ AlCl3(g) △H=b kJ•mol-1
反应Al2O3(s)+ 3C(s)=2Al(l)+ 3CO(g)的△H= kJ•mol-1(用含a、b的代数式表示)。
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g) N2(g)+ CO2(g) △H=Q kJ•mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+ CO2(g) △H=Q kJ•mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
|  时间(min) 时间(min)
浓度 (mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①T1℃时,该反应的平衡常数K=
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q 0(填“>”或“<”)。
④在恒容绝热条件下,能判断该反应一定达到化学平衡状态的依据是
a.单位时间内生成2nmolNO(g)的同时消耗nmolCO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
-
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s) = 6AlCl(g)+6CO(g) ΔH=a kJ·mol-1
②3AlCl(g) = 2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH = kJ·mol-1 (用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) ΔH =Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH =Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10 min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.单位时间内生成2 n mol NO(g)的同时消耗n mol CO2(g)
B.反应体系的温度不再发生改变
C.混合气体的密度不再发生改变
D 反应体系的压强不再发生改变








