-
化学与生产、生活和环境密切相关。下列有关说法正确的是
A. 编织渔网的尼龙绳的主要成分是纤维素
B. 文房四宝中的砚台,用石材磨制的过程是化学变化
C. 丝绸的主要成分是蛋白质,它属于天然高分子化合物
D. 月饼中的油脂易被氧化,保存时常放入装有硅胶的透气袋
难度: 中等查看答案及解析
-
下列装置进行有关实验操作或实验改进,正确的是
A. 测定空气中O2含量
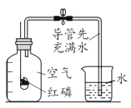
B. 萃取分液
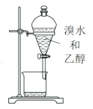
C. 冷凝回流
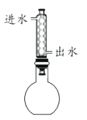
D. 制取并收集乙酸乙酯
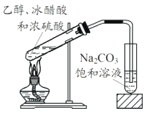
难度: 中等查看答案及解析
-
网络表情包“苯宝宝装纯(醇)”,该分子由“苯宝宝”拿一个氢原子换了个羟基形成,下列说法不正确的是
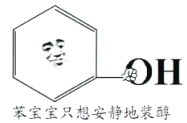
A. 苯宝宝只想安静地装醇,说明该分子不是醇
B. 该分子中所有原子一定共面
C. 该分子能和Na发生置换反应生成H2
D. 该分子苯环上的一个氢原子被-C4H9取代所得的同分异构体有12种
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1L0.5mol·L-1NH4C1溶液中含有NH4+的数目为0.5NA
B. 25℃时,pH=12的NaOH溶液含有的OH-数目为0.01NA
C. 32g18O2中含有的氧原子数是2NA
D. 质量均为78g的Na2O2和Na2S固体,其离子总数均为3NA
难度: 中等查看答案及解析
-
四种短周期元素X、Y、Z和M在周期表中的位置如图所示,Y原子序数是X的2倍。下列说法不正确的是
A. Z、M、X的简单离子半径依次减小
B. Y和M可形成离子化合物YM4
C. X的简单气态氢化物的稳定性强于Y的
D. M的最高价氧化物对应水化物的酸性比Z的强
难度: 中等查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,无水LiCl-KCl混合物受热熔融后,电池即可瞬间输岀电能。该电池总反应为:PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。下列有关说法不正确的是

A. 放电时,电子由Ca电极流出
B. 放电时,Li+向PbSO4电极移动
C. 负极反应式:PbSO4+2e-+Li+=Li2SO4+Pb
D. 每转移0.2mol电子,理论上生成还原产物Pb的质量为20.7g
难度: 中等查看答案及解析
-
25℃时,向某Na2CO3溶液中加入稀盐酸,溶液中含碳微粒的物质的量分数(φ)随溶液pH变化的部分情况如图所示。下列说法中正确的是

A. pH=7时, c(Na+)=(Cl- )+c(HCO3-)+2c(CO32-)
B. pH=8时,c(Na+)=c(C1-)
C. pH=12时, c(Na+ )>c(OH- )>c(CO32-)>c(HCO3-)>c(H+)
D. 25℃时,CO32-+H2O
HCO3-+OH-的水解平衡常数Kh=10-10mol·L-1
难度: 困难查看答案及解析

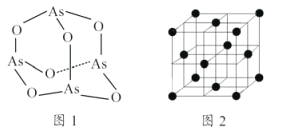
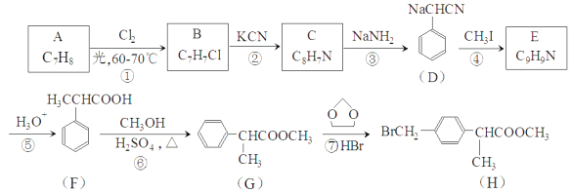
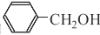 合成
合成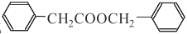 的合成路线______________________。
的合成路线______________________。