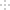-
高铁酸钾(K2FeO4)是一新型、高效、无毒的多功能水处理剂。
(资料)K2FeO4为紫色固体,微溶于KOH溶液,具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4。
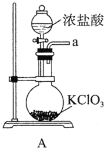
①A为制取氯气发生装置,其中盛放浓盐酸的仪器名称为___________。
②除杂装置B中的试剂为___________。
③C为制备K2FeO4装置,KOH溶液过量的原因是___________。
④D为尾气处理装置,发生反应的离子方程式为___________。
(2)探究 K2FeO4的性质。取C中紫色溶液,加入稀硫酸,产生黃绿色气体,得溶液a,经检验气体中含有Cl2。为证明K2FeO4能否氧化Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案I中溶液变红可知a中含有___________。该离子的产生___________(填“能”或“不能”)判断一定是由K2FeO4被Cl-还原而形成的。
②方案Ⅱ用KOH溶液洗涤的目的是___________。方案Ⅱ得出氧化性:Cl2___________FeO42-(填“>”或“<”)
(3)使用时经常通过测定高铁酸钾的纯度来判断其是否变质。K2FeO4在硫酸溶液中反应如下:_______ FeO42-+______H+===_______O2↑+________Fe3++________(配平及完成上述离子方程式)________。现取C中洗涤并干燥后样品的质量10g,加入稀硫酸,收集到0.672L气体(标准状况下)。则样品中高铁酸钾的质量分数约为___________。(计算结果保留到0.1%)
-
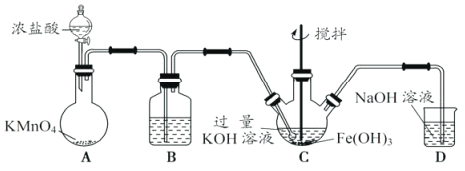
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液。K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO2并探究其性质。
(一)K2FeO4的制备
该小组用下图所示装置制备K2FeO4(夹持装置略)。
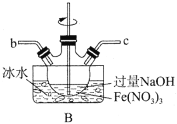
(1)以上装置图中有一处明显的错误请你帮助指出来:___________。B中应盛装的试剂是___________。
(2)写出A中发生反应的离子方程式:___________。
(3)C中发生的反应有Cl2+2OH-=Cl-+ClO-+H2O,还有生成K2FeO4的反应。写出得到紫色固体K2FeO4的化学方程式:___________。
(二)性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4。
(4)絮凝实验:甲同学取少量K2FeO4加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请结合方程式,说明K2FeO2的净水原理:___________。
(5)乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是____。
(6)丙同学取少量K2FeO4,向其中滴入MnSO4和适量H2SO4的混合溶液,振荡后溶液呈紫色,丙同学认为氧化性FeO42->MnO4-。请你设计一个实验,验证丙同学的结论是否正确:___________。
-
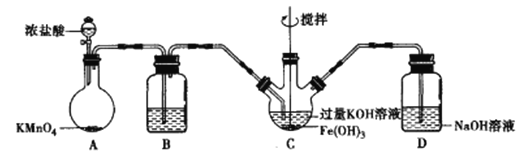
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。K2FeO4为紫色固体,微溶于KOH溶液。K2FeO4具有强氧化性,在酸性或中性溶液中迅速产生O2,在碱性溶液中较稳定。某学习小组设计了下面的实验制备K2FeO2并探究其性质。
Ⅰ.K2FeO4的制备
该小组用如图所示装置制备K2FeO4(夹持装置略)。
(1)以上装置图中有一处明显的错误请你帮助指出来:___________。B中应盛装的试剂是___________。
(2)写出A中发生反应的离子方程式__________________________________。
(3)C中发生的反应有Cl2+2OH-===Cl-+ClO-+H2O,还有生成K2FeO4的反应。写出得到紫色固体K2FeO4的化学方程式为____________。
Ⅱ.性质探究
用KOH溶液充分洗涤C中所得固体得到固体物质K2FeO4。
(4)絮凝实验:甲同学取少量K2FeO4加入浑浊的泥浆水中,发现产生气体,搅拌,浑浊的泥浆水很快澄清。请结合方程式,说明K2FeO4的净水原理:_________________。
(5)乙同学取少量K2FeO4,向其中滴入稀盐酸发现产生黄绿色气体。产生黄绿色气体的原因可能是___。
(6)丙同学取少量K2FeO4,向其中滴入MnSO4和适量H2SO4的混合溶液,振荡后溶液呈紫色,丙同学认为氧化性FeO42->MnO4-。请你设计一个实验,验证丙同学的结论是否正确:_____________
-
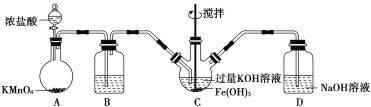
高铁酸钾是一种高效多功能的新型非氯绿色消毒剂,主要用于饮水处理。实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)
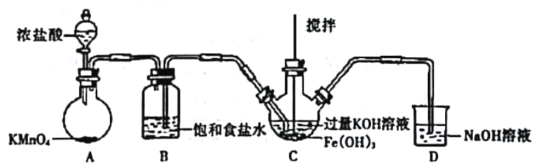
①如图所示,A为氯气发生装置。装置A、B、C、D中存在错误的是______________(填序号)。
②C中得到紫色固体和溶液。C中通入氯气发生反应,生成高铁酸钾(K2FeO4)的化学方程式为_______,此外Cl2还可能与过量的KOH反应。
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4,氧化了Cl-而产生Cl2,设计以下方案:
| 方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案I中溶液变红可知溶液a中含有__________离子,但该离子的存在不能判断一定是K2FeO4,氧化了Cl2,因为K2FeO4,在酸性溶液中不稳定,请写出K2FeO4在酸性溶液中发生反应的离子方程式___________________________________。
ii.方案Ⅱ可证明K2FeO4,氧化了Cl-.用KOH溶液洗涤的目的是_______________。
②根据K2FeO4的制备实验得出:氧化性Cl2_____FeO42- (填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系恰好相反,原因是_______________。
(3)若在制备装置C中加入Fe(OH)3的质量为14.0g,充分反应后经过滤、洗涤、干燥得K2FeO4固体19.3g,则K2FeO4的产率为______________。
-
高铁酸钾(K2FeO4,暗紫色固体),是一种新型、高效、多功能的水处理剂。完成下列填空:
(1)K2FeO4溶于水得到浅紫红色的溶液,且易水解,生成氧气和氢氧化铁。写出该水解反应的离子方程式_________;说明高铁酸钾做水处理剂的原理______。
(2)下图分别是1mol/L的K2FeO4溶液在不同pH和温度下c(FeO42-)随时间的变化曲线。
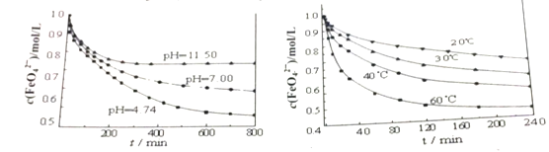
根据以上两图,说明配制K2FeO4溶液的注意事项______________。
-
实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4作为高效、多功能水处理剂的原因是______________________________。
(2)制备K2FeO4(夹持装置略)
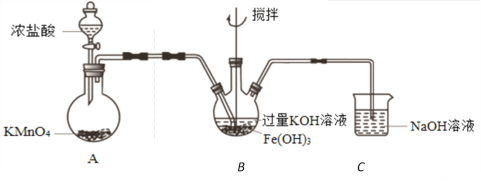
①A为氯气发生装置。A中反应方程式是_____________________________。
②该装置有明显不合理设计,如何改进?____________________________。
③改进后,B中得到紫色固体和溶液。B中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有____________________________。
(3)探究K2FeO4的性质(改进后的实验)
①取B中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤B中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
a.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由_________________________产生(用方程式表示)。
b.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________。
②根据K2FeO4的制备实验和方案Ⅱ实验表明Cl2和 的氧化性强弱关系相反,原因是_____________。
的氧化性强弱关系相反,原因是_____________。
-
实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4作为高效、多功能水处理剂的原因是______________________________。
(2)制备K2FeO4(夹持装置略)
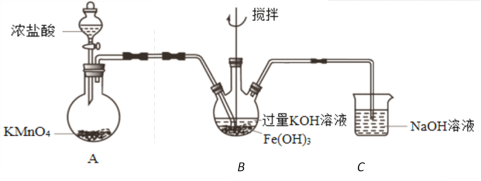
①A为氯气发生装置。A中反应方程式是_____________________________。
②该装置有明显不合理设计,如何改进?____________________________。
③改进后,B中得到紫色固体和溶液。B中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有____________________________。
(3)探究K2FeO4的性质(改进后的实验)
①取B中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
| 方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
| 方案Ⅱ | 用KOH溶液充分洗涤B中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
a.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由_________________________产生(用方程式表示)。
b.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________。
②根据K2FeO4的制备实验和方案Ⅱ实验表明Cl2和 的氧化性强弱关系相反,原因是_____________。
的氧化性强弱关系相反,原因是_____________。
-
高铁酸钾( )是一种新型、高效、多功能水处理剂,且不会造成二次污染。
)是一种新型、高效、多功能水处理剂,且不会造成二次污染。
查阅资料:
① 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
② 与
与 溶液在20℃以下反应生成
溶液在20℃以下反应生成 ,在较高温度下则生成
,在较高温度下则生成 。
。
(1)实验室常利用氯气制备 后与
后与 、
、 反应制备
反应制备 。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是________。
。根据下列仪器,请你组装合理、简洁的实验装置,所用装置的接口连接顺序是________。
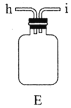
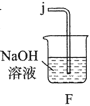
(2)写出装置A中发生反应的离子方程式________。
(3)三颈烧瓶用冰水浴的原因是________,A处盛放 的仪器名称是________。
的仪器名称是________。
(4)将实验得到的 再加入饱和
再加入饱和 溶液中,可析出紫黑色的
溶液中,可析出紫黑色的 粗晶体,其原因是________。
粗晶体,其原因是________。
(5)用滴定法测定所制粗 的纯度(杂质与
的纯度(杂质与 不反应):取
不反应):取 粗
粗 样品,加入足量硫酸酸化的
样品,加入足量硫酸酸化的 溶液,充分反应后,用
溶液,充分反应后,用 标准溶液滴定生成的I2,滴定消耗标准溶液的体积为
标准溶液滴定生成的I2,滴定消耗标准溶液的体积为 。涉及的反应有:
。涉及的反应有: ,
, 。
。
①滴定时选用的指示剂是________,滴定终点的现象是________。
②制得粗 的纯度是________。
的纯度是________。
-
(题文)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
(1)工业上的湿法制备方法是用KClO 与Fe(OH)3在KOH 存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为_____________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
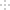
①操作(Ⅰ)的方法为在隔绝空气条件下________、________、过滤、洗涤、隔绝空气减压干燥。
②写出产生X气体的化学方程式_______________________________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液;
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中;
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-;
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)溶液的体积,做3次平行实验,平均消耗30.00mL的(NH4)2Fe(SO4)2溶液。
已知:K2Cr2O7水溶液显黄色,滴定时发生的反应为:6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mLK2FeO4溶液加入到锥形瓶中所用的仪器是________。
②写出步骤3中发生反应的例子方程式___________________________________。
③根据上述实验数据,测定该样品中K2FeO4的质量分数为___________。(K2FeO4摩尔质量为198g/mol)。
-
(题文)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。
(1)工业上的湿法制备方法是用KClO 与Fe(OH)3在KOH 存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为_____________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
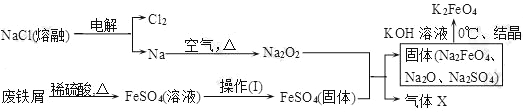
①操作(Ⅰ)的方法为在隔绝空气条件下________、________、过滤、洗涤、隔绝空气减压干燥。
②写出产生X气体的化学方程式_______________________________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液;
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中;
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-;
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)溶液的体积,做3次平行实验,平均消耗30.00mL的(NH4)2Fe(SO4)2溶液。
已知:K2Cr2O7水溶液显黄色,滴定时发生的反应为:6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mLK2FeO4溶液加入到锥形瓶中所用的仪器是________。
②写出步骤3中发生反应的例子方程式___________________________________。
③根据上述实验数据,测定该样品中K2FeO4的质量分数为___________。(K2FeO4摩尔质量为198g/mol)。