-
下列根据实验现象得出的实验结论正确的是
选项
实验操作
实验现象
实验结论
A
向KNO3和KOH 混合溶液中加入铝粉并加热,管口放湿润的红色石蕊试纸
试纸变为蓝色
NO3-被还原为NH3
B
将Fe(NO3 )2样品落于稀硫酸后,滴加KSCN溶液
溶液变成红色
Fe(NO3 )2样品中一定含有Fe2+
C
向浓度均为0 1mol/L的Na2CO3和Na2S混合溶液中滴入少量AgNO3溶液
产生黑色沉淀(Ag2S)
Ksp(Ag2S)>Ksp(Ag2CO3)
D
向KI溶液中加入少量苯,然后加入FeCl3溶液
有机层呈橙红色
还原性:Fe2+>I-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中可能大量共存的是( )
A. pH=1的溶液中:Na+、K+、MnO4-、CO32-
B. 无色溶液中:Cu2+、Al3+、NH4+、Cl-
C. 由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
D. 0.1mol·L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 放热反应不需要加热就能发生
B. 升高温度或加入催化剂,均可以改变化学反应的反应热
C. 同温同压下,H2(g)+Cl2(g)==2HCl(g)在光照和点燃条件下的ΔH不同
D. 物质发生化学变化,一定伴随着能量变化
难度: 简单查看答案及解析
-
Cl2通入水中发生如下反应Cl2+H2O
HCl+HClO,欲增大所得溶液中HClO的浓度,应采取的措施为 ( )
A. 加NaOH固体 B. 加Na2CO3固体 C. 加水 D. 通入NH3气
难度: 中等查看答案及解析
-
沼气的主要成份是CH4 , 0.5molCH4完全燃烧生成二氧化碳和液态水时放出445kJ热量.下列热化学方程式正确的是( )
A. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=+890 kJ/mol
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890kJ/mol
C. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣445kJ/mol
D. CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ/mol
难度: 中等查看答案及解析
-
下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1
B. 含等物质的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)]
C. 0.1mol·L-1盐酸与0.2mol·L-1氨水等体积混合:c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)
D. 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-)
难度: 中等查看答案及解析
-
已知反应:①101kPa时,C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H2=-57.3kJ/mol
下列结论正确的是( )
A. 若碳的燃烧热用△H3来表示,则△H3<△H1
B. 若碳的燃烧热用△H3来表示,则△H3>△H1
C. 浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D. 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
难度: 简单查看答案及解析
-
下列有关反应速率的说法正确的是( )
A. 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B. 100mL 2mol•L-1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. SO2的催化氧化反应是一个放热的反应,所以升高温度,反应速率变慢
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢
难度: 中等查看答案及解析
-
下列说法或表示正确的是( )
A. 若将等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B. 由“c(石墨)=c(金刚石)△H=+1.9KJ/mol”可知,金刚石没有石墨稳定
C. 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H1,
CH3COOH(aq)+OH-(aq)═H2O(l)+CH3COO-(aq)△H2,则△H1>△H2
D. 在101KPa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=285.8KJ/mol
难度: 中等查看答案及解析
-
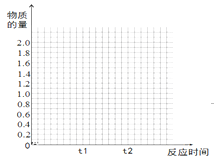
在一恒温恒容密闭容器中充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。下列说法正确的是( )
A. 反应进行到3min时,该反应达到平衡状态
B. 从反应开始到平衡,CO2的转化率为25%
C. 第3min时,氢气的平均反应速率为1.5mol/(L·min)
D. 该温度下,反应的平衡常数的值为16/3
难度: 困难查看答案及解析
-
在一个固定容积的密闭容器中充入3 mol NO2,—定温度下建立如下平衡:2NO2
N2O4,此时平衡混合气中NO2的体积分数为x%,若再充入1mol N2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是( )
A. x>y B. x<y C. x=y D. 不能确定
难度: 困难查看答案及解析
-
已知Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g)ΔH<0,则下列叙述不正确的是( )
A. 该反应中旧化学键断裂需要吸收能量,新化学键形成需要放出能量,所以反应前后物质具有的总能量不变
B. 上述热化学方程式中的ΔH的值与实验测定中反应物的用量无关
C. 该反应的化学能可以转化为其他形式的能
D. 反应物的总能量高于生成物的总能量
难度: 中等查看答案及解析
-
25℃时,下列溶液的离子浓度关系式正确的是( )
A. pH=a的醋酸溶液稀释10倍后,其pH=b,则b=a+1
B. 浓度相同的①NH4Cl;②CH3COONH4;③NH4HSO4三种溶液的c(NH4+):①>③>②
C. 浓度相同的氨水与盐酸等体积混合:c(NH4+)>c(Cl﹣)>c(H+)>c(OH﹣)
D. 将amol·L﹣1CH3COOH与bmol·L﹣1NaOH溶液等体积混合,测得溶液pH为7,则a>b
难度: 困难查看答案及解析
-
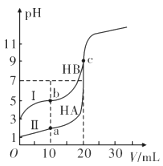
下列图示与对应的叙述正确的是( )

A. 图甲为在水溶液中H+和OH-的浓度变化曲线,恒温稀释可实现a→b的转化
B. 图乙为H2O2在有、无催化剂下的分解反应曲线b表示有催化剂时的反应
C. 图丙可表示用0.0110mol/L盐酸滴定0.0110mol/L氨水时的滴定曲线
D. 图丁为NaCl中混有少量KNO3,除去KNO3可在较高温度下制得浓溶液再冷却结晶、过滤、干燥
难度: 中等查看答案及解析
-
下列判断中,正确的是( )
A. 已知25 ℃时NH4CN显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN)
B. 25 ℃时,Mg(OH)2固体在20 mL0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1 NH4Cl溶液中的Ksp小
C. pH试纸测得新制氯水的pH为4
D. FeCl3溶液和Fe2(SO4)3溶液加热蒸干.灼烧都得到Fe2O3
难度: 中等查看答案及解析
-
下列盐类水解的应用,不正确的是
A. 实验室配制氯化铁溶液时,滴入少量稀硫酸抑制水解
B. 为使纯碱溶液的去油污效果更好,可以使用热的纯碱溶液
C. 明矾可用于净水,是由于溶于水后产生的Al(OH)3胶体具有吸附作用
D. 铵态氮肥不能和草木灰混合施用,是由于NH4+与CO32﹣互相促进水解,肥效下降
难度: 中等查看答案及解析
-
下列关于化学反应的活化能说法错误的( )
A. 活化能是决定化学反应速率快慢的本质因素
B. 溶液中Ag+和Cl-结合形成沉淀几乎不需要活化能
C. 煤的形成需要漫长的地质年代主要是因为该反应的活化能很大
D. 活化能只受温度影响,与其他因素无关
难度: 简单查看答案及解析
-
向一种一元强酸HA溶液中加入一种碱MOH,溶液呈中性,下列判断正确的是( )
A. 加入的碱过量
B. 生成的盐发生水解
C. 反应后溶液中c(A-)=c(M+)
D. 混合前酸与碱中溶质的物质的量相等
难度: 中等查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)反应过程中能量变化如图所示(图中E表示正反应的活化能,E2表示逆反应的活化能。下列有关叙述正确的是( )
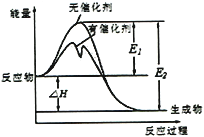
A. 该反应的逆反应为放热反应,升高温度可提高活化分子的百分数
B. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
C. 该反应中,反应物的总键能大于生成物的总键能
D. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)
2SO3(g) ΔH =-2akJ·mol-1
难度: 中等查看答案及解析