-
已知2A2(g)+B2(g)  2C3(g) △H=-Q1kJ·mol-1(Q>0)。在一个有催化剂的容积不变的密闭容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol/L。放出热量为Q2KJ
2C3(g) △H=-Q1kJ·mol-1(Q>0)。在一个有催化剂的容积不变的密闭容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol/L。放出热量为Q2KJ
(1)达到平衡时,A2的转化率为_______。
(2)达到平衡后,若向容器中通入少量的氩气,A2的转化率将______(填增大、减小或不变))
(3)若在原来的容器中只加入2mol C3,500℃时充分反应达平衡后,吸收热量QkJ,C3浓度________(填>、=、<)wmol/L。
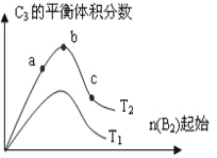
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是_____;

a.反应速率c>b>a
b.达到平衡时A2的转化率大小为b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2mol A2和1mol B2,500℃时充分反应达平衡后,放出热量Q1kJ,则Q2_________Q1(填>、=、<)。
(6)下列措施可以同时提高反应速率和B2的转化率是______(填选项序号)。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的C3 d.升高温度
-
已知2A2(g)+B2(g)  2C3(g) △H=-Q1kJ·mol-1(Q>0)。在一个有催化剂的容积不变的密闭容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol/L。放出热量为Q2KJ
2C3(g) △H=-Q1kJ·mol-1(Q>0)。在一个有催化剂的容积不变的密闭容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol/L。放出热量为Q2KJ
(1)达到平衡时,A2的转化率为_______。
(2)达到平衡后,若向容器中通入少量的氩气,A2的转化率将______(填增大、减小或不变))
(3)若在原来的容器中只加入2mol C3,500℃时充分反应达平衡后,吸收热量QkJ,C3浓度________(填>、=、<)wmol/L。
(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是_____;

a.反应速率c>b>a
b.达到平衡时A2的转化率大小为b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容器,起始时加入2mol A2和1mol B2,500℃时充分反应达平衡后,放出热量Q1kJ,则Q2_________Q1(填>、=、<)。
(6)下列措施可以同时提高反应速率和B2的转化率是______(填选项序号)。
a.选择适当的催化剂 b.增大压强 c.及时分离生成的C3 d.升高温度
-
已知2A2(g)+B2(g) 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度___(填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系:Q3=____________。

(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____________;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容容器,起始时加入4 molA2和2 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2__________Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是___________(填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
-
已知2A2(g)+B2(g) 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达到平衡时, A2的转化率为____________。(用Q1 、Q2表示)
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将________(填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3 ,500℃时充分反应达平衡后,吸收热量Q3 kJ,则Q1、Q2、Q3 之间满足何种关系:Q3=____________。
(4)能说明该反应已经达到平衡状态的是_______
A.v(C3)=2v (B2) B.容器内压强保持不变
C.A2 与 B2 的转化率相等 D.容器内的气体密度保持不变
(5)改变某一条件,得到如图所示的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是____________(填序号)
A.反应速率:c>b>a B.达到平衡时A2的转化率大小为:b>a>c
C.T2>T1
(6)若将上述容器改为恒压容容器,起始时加入2 molA2和1 molB2,500℃时充分反应达平衡后,放出热量Q4 kJ,则Q2__________Q4(填“>”、“<”或“=”)。
-
已知2A2(g)+B2(g) 2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 mo
2C3(g);△H=-Q1 kJ/mol(Q1>0), 在一个有催化剂的容积不变的密闭容器中加入2 mo lA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
lA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol·L-1,放出热量为Q2 kJ。
(1)达 到平衡时, A2的转化率为 。
到平衡时, A2的转化率为 。
(2)达到平衡后,若向原容器中通入少量的氩气,A2的转化率将 (填“增大“、“减小”或“不变”)
(3)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度 (填>、=、<)w mol·L-1,Q1、Q2、Q3 之间满足何种关系:Q3= 。

(4)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是 ;
a.反应速率c>b>a
b.达到平衡时A2的转化率大小为:b>a>c
c.T2>T1
d.b点A2和B2的物质的量之比为2:1
(5)若将上述容器改为恒压容容器,起始时加入4 molA2和2 molB2,500 ℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4(填“>”、“<”或“=”)。
℃时充分反应达平衡后,放出热量Q4 kJ,则Q2 Q4(填“>”、“<”或“=”)。
(6)下列措施可以同时提高反应速率和B2的转化率是 (填选项序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的C3 d.升高温度
-
(一)已知2A2(g)+B2(g) 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
(1)比较a___b(填“>、=、<”)
(2)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(3)下图表示此反应的反应速率v和时间t的关系图。根据下图判断,在t1和t4时刻改变的外界条件分别是_______________和 _____________ 。

(二)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:

(1)根据上图,该反应达到平衡时H2的转化率等于__________。
(2)第5分钟末,保持其它条件不变,若改变反应温度,达新平衡后NH3的物质的量浓度不可能为_________。(填序号)。
a 0.20mol·L-1 b 0.12 mol·L-1 c 0.10 mol·L-1 d 0.08 mol·L-1
(3)若在第5分钟末将容器的体积缩小一半后,在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol·L-1 ),请在上图中画出第5分钟到9分钟NH3浓度的变化曲线。____________
-
(一)已知2A2(g)+B2(g) 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
(1)比较a___b(填“>、=、<”)
(2)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(3)下图表示此反应的反应速率v和时间t的关系图。根据下图判断,在t1和t4时刻改变的外界条件分别是_______________和 _____________ 。

(二)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:

(1)根据上图,该反应达到平衡时H2的转化率等于__________。
(2)第5分钟末,保持其它条件不变,若改变反应温度,达新平衡后NH3的物质的量浓度不可能为_________。(填序号)。
a 0.20mol·L-1 b 0.12 mol·L-1 c 0.10 mol·L-1 d 0.08 mol·L-1
(3)若在第5分钟末将容器的体积缩小一半后,在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol·L-1 ),请在上图中画出第5分钟到9分钟NH3浓度的变化曲线。____________
-
(16分) 已知2A2(g)+B2(g) 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ。
(1)比较a b(填“>、=、<”)
(2)若将反应温度升高到700℃,该反应的平衡常数将 (填“增大”“减小”或“不变”)。若将反应容器的体积压缩,平衡向 方向移动(填“正反应”或”逆反应”),该反应的平衡常数将 。(填“增大”“减小”或“不变”)
(3)若在原来的容器中,只加入2 mol C3,500 ℃时充分反应达平衡后,吸收热量ckJ,C3的浓度也是w mol/L,则c 等于 (用a、b表示)。
(4)能说明该反应已经达到平衡状态的是
A 2v逆(A2)=v正(B2) B v正(C3)=2v正(B2)
C A2与C3浓度相等 D.混合气体的平均相对分子质量不变
E.容器内压强保持不变 F.容器内密度保持不变
(5)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A2和1molB2,500 ℃时充分反应达平衡后,放出热量dkJ,则d b(填“>、=、<”)
(7)下图表示此反应的反应速率v和时间t的关系图。
根据下图判断,在t1和t4时刻改变的外界条件分别是 和 。

-
已知2A2(g)+B2(g)  2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
2C3(g);△H=-akJ·mol-1(a >0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol·L-1,放出热量b kJ。请回答下列问题:
(1)比较a___________b填“>”、“=”、“<”)。
(2)若将反应温度升高到700℃,该反应的平衡常数将_____________(“增大”、“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是
A.V(C3)=2V(B2) B.容器内气体压强保持不变
C.V逆(A2)=2V正(B2) D.容器内的气体密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_____________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
-
已知2A2(g)+B2(g) 2C3(g),ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
2C3(g),ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡后C3的浓度为ω mol·L-1,放出热量b kJ。
(1)比较a_______b(填“>”“=”或“<”)。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将___________ (填“增大”“减小”或“不变”)。
(3)能说明该反应已经达到平衡状态的是___________。
a.v(C3)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的操作是__________。
a.及时分离出C3气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
2C3(g) △H=-Q1kJ·mol-1(Q>0)。在一个有催化剂的容积不变的密闭容器中加入2molA2和1molB2,在500℃时充分反应,达平衡后C3的浓度为w mol/L。放出热量为Q2KJ








