-
一定能在下列溶液中大量共存的离子组是( )
A. 水电离产生的c(OH-)=1×10-12 mol·L-1液中:NH4+、Na+、Cl-、HCO3-
B. 能使pH试纸变深蓝色的溶液中:Na+、AlO2-、S2-、CO32-
C. 含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D. 澄清透明的无色溶液中:ClO-、MnO4-、Al3+、SO42-
难度: 中等查看答案及解析
-
化学与社会、生产、生活、环境等密切相关,下列说法正确的是( )
A. 氟利昂作制冷剂会加剧雾霾天气的形成
B. 蚕丝和棉花的组成元素相同,结构不同,因而性质不同
C. 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D. 利用二氧化碳制造全降解塑料,可以缓解温室效应
难度: 简单查看答案及解析
-
下列表述错误的是( )
A. CS2的结构式为:S=C=S
B. 6CO2+6H2O
C6H12O6+6O2,该变化中光能转变为化学能
C. CO2(g)+C(s)
2CO(g)△H>0,△S>0,该反应常温下能自发进行
D. 可以用酸性高锰酸钾溶液来鉴别乙醇、乙酸和苯
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 在标准状况下,22.4L苯含有的分子数为NA
B. 120g NaHSO4固体含有H+的数目为NA
C. 17.6g丙烷中所含的共价键数目为4NA
D. 20ml2mol/LH2O2完全分解,转移的电子数为0.08NA
难度: 中等查看答案及解析
-
下列各组物质充分反应后过滤,将滤液加热、蒸干至质量不变,最终不能得到纯净物的是( )
A. 向含1 mol Ca(HCO3)2的溶液中加入1 mol Na2O2
B. 向带有氧化膜的铝片中加入盐酸
C. 向漂白粉溶液中通入过量CO2
D. 向含1 mol KAl(SO4)2的溶液中加入2 mol Ba(OH)2
难度: 中等查看答案及解析
-
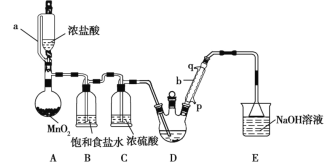
下列实验中,所选装置或实验设计合理的是( )
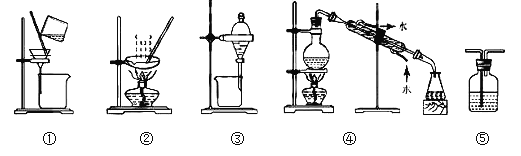
A. 用图①和②所示装置进行粗盐提纯
B. 用乙醇提取碘水中的碘选择图③所示装置
C. 用图④所示装置进行石油分馏实验制取汽油
D. 图⑤所示装置中盛有饱和Na2SO3溶液除去SO2中含有的少量HCl
难度: 中等查看答案及解析
-
如表实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
实验
现象
结论
A
向装有石灰石的简易启普发生器中加入浓醋酸,将产生的气体通入苯酚钠溶液中
苯酚钠溶液产生浑浊
酸性:醋酸>碳酸>苯酚
B
将氯水加入到NaBr溶液中,所得混合溶液加入到KI和CCl4混合溶液中,振荡、静置
先无色NaBr溶液变黄色、后下层溶液显紫红色
非金属性:
Cl>Br>I
C
向装有固体NaOH试管中加入浓氨水,产生的气体通入到AlCl3溶液中,
AlCl3溶液中出现白色浑浊
碱性:NaOH>NH3·H2O>Al(OH)3
D
向等浓度硫酸钠和硫化钠的混合溶液中滴入少量AgNO3溶液
出现黑色沉淀
说明Ksp(Ag2SO4)>Ksp(Ag2S)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
有机物M、N、Q之间的转化关系为,下列说法正确的是( )
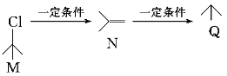
A. M的同分异构体有3种(不考虑立体异构)
B. N分子中所有原子共平面
C. Q的名称为异丙烷
D. M、N、Q均能与溴水反应
难度: 中等查看答案及解析
-
下列各组物质按右图所示转化关系每一步都能一步实现的是( )
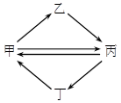
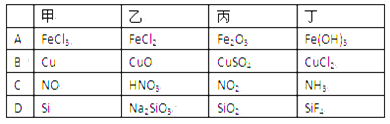
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
某学习小组为研究电化学原理,设计下图装置。下列叙述正确的是( )
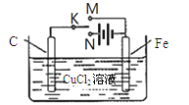
A. K与M、N均断开,一段时间后电解质溶液质量变大
B. K分别与M、N相连时,铁均受到保护
C. K与M相连时,每转移1mol电子Fe表面生成32gCu
D. K与N相连时, 碳棒上产生使湿润的淀粉碘化钾试纸变蓝的气体
难度: 困难查看答案及解析
-
Kolbe法制取乙烯的装置如图所示,电极a上的产物为乙烯和碳酸根离子。下列说法正确的是( )
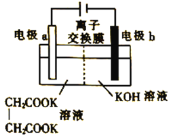
A. 该装置将化学能转化为电能
B. 图中为阳离子交换膜
C. 阴极周围溶液的pH不断减小
D. 每生成1mol乙烯,电路中转移2mol电子
难度: 中等查看答案及解析
-
已知部分弱酸的电离平衡常数如下表所示
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数Ka(25℃)
1.75×10-5
2.98×10-8
Ka1=4.3×10-7
Ka2=5.61×10-11
Ka1=1.54×10-7
Ka2=1.02×10-7
下列离子方程式正确的是( )
A. 少量的CO2通入NaClO溶液中:CO2+H2O+2C1O-=CO32-+2HClO
B. 少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-=SO32-+2HCO3-
C. 少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D. 相同浓度的NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
难度: 中等查看答案及解析
-
常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断不正确的是( )
A. 该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO)
B. 第一阶段应选择稍高于42.2℃的反应温度
C. 第二阶段,230℃时Ni(CO)4分解率较高
D. 其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变
难度: 中等查看答案及解析
-
已知HCN、CN-在溶液中存在下列平衡及其对应的平衡常数:①HCN
H++ CN- △H 1>0,K1 ②CN-+H2O
HCN+OH- △H 2>0,K2,常温下(K1= 6.2×10-10),将等体积、等物质的量浓度的HCN和NaCN溶液混合,下列叙述正确的是( )
A. 混合溶液的pH<7
B. 对混合溶液进行微热,K1 增大、K2 减小
C. K2≈ 1.6×10-5
D. c(Na+) = c(HCN) + c(CN—)
难度: 困难查看答案及解析
-
25℃时在10 mL 0.1mol·L—1Na2CO3溶液中逐滴加入0.1 mol·L—1HCl溶液20 mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法正确的是( )

A. 0.1 mol·L—1Na2CO3溶液中c(Na+)+c(H+)=c(OH—)+c(CO32—)+c(HCO3—)
B. 当加入10mL盐酸时,所得混合溶液pH>7
C. 当pH=8时,c(Na+)=c(CO32—)+c(HCO3—)+c(H2CO3)
D. 在M点:c(CO32—)=c(HCO3—)>c(Na+)>c(OH—)>c(H+)
难度: 中等查看答案及解析
-
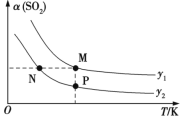
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法错误的是
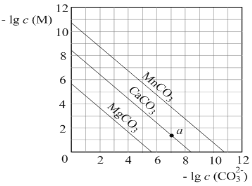
A. Ksp(MnCO3)的数量级为10-11
B. MgCO3的悬浊液中加入少量水充分振荡,c(Mg2+)不变
C. a点表示的溶液中,c(Ca2+)>c(CO32-)
D. 向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
难度: 困难查看答案及解析