-
下列哪一个反应表示二氧化硫被还原 ( )
A. SO2+2H2O+Cl2===H2SO4+2HCl B. SO2+2H2S===2H2O+3S
C. SO2+2NaOH===Na2SO3+H2O D. SO2+Na2CO3===Na2SO3+CO2↑
难度: 中等查看答案及解析
-
生菜无土栽培营养液的配方要求KNO3、MgSO4、NH4NO3 物质的量之比为1∶2∶1。配制该营养液,已溶解0.02 mol KNO3、0.02 mol NH4NO3,还需MgSO4的质量为
A. 1.2 g B. 2.4 g C. 3.6 g D. 4.8 g
难度: 简单查看答案及解析
-
Cu2O是赤铜矿的主要成分,Cu2S是辉铜矿的主要成分。铜的冶炼过程通常发生反应:Cu2S+2Cu2O===6Cu+SO2↑,下列有关说法正确的是
A. 该反应中有三种元素的化合价发生了变化
B. 每生成0.1 mol Cu,转移0.2 mol 电子
C. Cu2S在反应中既是氧化剂又是还原剂
D. Cu既是氧化产物又是还原产物
难度: 简单查看答案及解析
-
下列物质的水溶液能导电,但属于非电解质的是
A. CH3COOH B. Cl2 C. NH4HCO3 D. SO2
难度: 中等查看答案及解析
-
下列关于FeCl3溶液和Fe(OH)3胶体的说法中正确的是( )
A. 都呈红褐色
B. 向Fe(OH)3胶体中滴加几滴浓盐酸,可能看到有沉淀产生
C. 利用滤纸过滤的方法可以分离两者
D. 微粒大小都在1~100nm之间
难度: 中等查看答案及解析
-
在某稀溶液中含有0.1 mol HNO3和0.1 mol H2SO4,向其中加入9.6 g铜粉,充分反应后产生的气体在标准状况下的体积为( )
A.1.12 L B.1.68 L C.2.24 L D.3.36 L
难度: 简单查看答案及解析
-
Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项
A
B
C
D

a
Na
Al
Fe
Cu
b
NaOH
Al2O3
FeCl3
CuSO4
c
NaCl
Al(OH)3
FeCl2
CuCl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.足量的CO2与39gNa2O2发生反应,转移的电子数为NA
B.100mL 1mol/LFeCl3溶液中,阴、阳离子总数大于0.4NA
C.用惰性电极电解硫酸铜溶液,若生成1molO2,则转移电子数为2NA
D.18g的D2O与NA个CH4具有相同的电子数
难度: 困难查看答案及解析
-
由下列实验事实所列出的相应结论正确的是( )
选项
实验事实
结论
A
Cl2的水溶液可以导电
Cl2是电解质
B
取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀
该溶液中可能含有SO42﹣
C
取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为血红色
该Fe(NO3)2试样已经变质
D
SO2通入硝酸钡溶液出现白色沉淀
BaSO3不溶于强酸
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
与3.2 g SO2所含的氧原子数相等的NO2的质量为
A. 2.3 g B. 3.2 g C. 4.6 g D. 6.4 g
难度: 简单查看答案及解析
-
在相同条件下,密封容器中气体的分子数与表现出的压强成正比。若将m克焦炭与n克氧气同时放入一密封容器中,测得压强为p1;在一定条件下,当容器内物质充分发生反应后,恢复到原温度时,测得压强为p2。若p1=p2,则两者的质量之比m:n应满足的关系最准确的是( )
A、等于3:8 B、大于3:8 C、小于或等于3:8 D、大于3:4
难度: 困难查看答案及解析
-
下列各组物质间的反应既属于氧化还原反应,又属于离子反应的是( )
A.Zn与稀H2SO4
B.NaCl溶液与AgNO3溶液
C.H2与O2
D.Na2O与H2O
难度: 简单查看答案及解析
-
下列实验装置设计不能达到目的的是
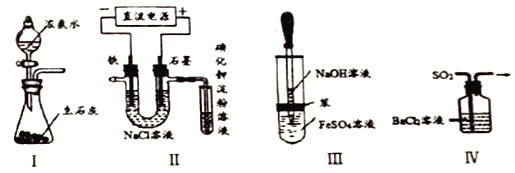
A. 实验I:所示装置可制备氨气 B. 实验Ⅱ:检验电解饱和食盐水的产物Cl2
C. 实验Ⅲ:制取并观察Fe(OH)2沉淀 D. 实验IV:吸收SO2
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 钠和冷水反应:Na+2H2O == Na++2OH-+H2↑
B. 金属铝溶于氢氧化钠溶液:Al+2OH-== AlO2—+H2↑
C. 金属铝溶于盐酸中:2Al+6H+ == 2Al3++3H2↑
D. 铁跟稀硫酸反应:Fe+2H+ == Fe3++H2↑
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是 ( )
A. 1 mol/L Na2CO3溶液中的Na+ 数目为2NA
B. 标准状况下,1 mol CH2Cl2所占有的体积约为22.4L
C. 常温常压下,38 g 18OH-中含质子数20NA
D. 14g C2H4和C3H6的混合气体含有的原子总数为3NA
难度: 中等查看答案及解析
-
有一种铁的“氧化物”样品,用5mol/L盐酸200mL恰好完全溶解,所得溶液还能吸收标况下2.24L氯气,恰好使其中Fe2+全部转化成Fe3+,该样品可能的化学式是 ( )
A.Fe2O3 B.Fe3O4 C.Fe4O5 D.Fe5O7
难度: 简单查看答案及解析
-
下列数量的物质中含原子个数最多的是( )
A. 0.4mol 氧气 B. 4℃时,5.4mLH2O
C. 标况下5.6L 二氧化碳 D. 10 g 氖
难度: 简单查看答案及解析
-
下列推断不正确的是( )
A. 工业上可以用碳还原二氧化硅得到硅和二氧化碳
B. 制普通玻璃的主要原料是纯碱、石灰石、石英
C. Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
D. Fe与S直接化合生成FeS;Al与S也可以直接化合得到Al2S3
难度: 中等查看答案及解析