-
下列说法中正确的是
A. 某微粒核外电子排布为2、8结构,则该微粒一定是氖原子
B. 最外层电子达到稳定结构的微粒只能是稀有气体的原子
C. 某元素原子的最外层只有2个电子,则该元素一定是金属元素
D. F-、Na+、Mg2+、Al3+是和Ne原子具有相同电子层结构的离子
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. Xe元素的所在族的原子的外围电子排布式均为ns2np6,属于非金属元素
B. 在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
C. 某基态原子核外电子排布图为
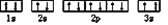 它违背了泡利原理
它违背了泡利原理D. 某外围电子排布为4f75d16s2基态原子,该元素位于周期表中第六周期第ⅢB族
难度: 中等查看答案及解析
-
对氧原子核外两个未成对电子的描述,正确的是
A. 能量不同 B. 自旋方向不同
C. 电子云形状相同 D. 在同一轨道上
难度: 中等查看答案及解析
-
下列各组原子中彼此化学性质一定相似的是
A. 最外层都只有一个电子的X、Y原子
B. 2p轨道上有一对成对电子的X原子和3p轨道上只有一对成对电子的Y原子
C. 原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
D. 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
难度: 中等查看答案及解析
-
通常状况下,NCl3是一种油状液体,下列对NCl3的有关叙述正确的是
A. CCl4中C—Cl键键长比NCl3中N—Cl键键长短
B. PCl3中P—Cl键键能比NCl3中N—Cl键键能高
C. NCl3分子中的所有原子均达到8电子稳定结构
D. NCl3分子的空间构型为平面三角形
难度: 中等查看答案及解析
-
与卤素单质化学性质相似的物质称为拟卤素或类卤素,如氰气,它的结构式为N≡C—C≡N,下列说法不正确的是
A. 其中叁键的键长比单键要短
B. 分子中含3个σ键和3个π键
C. 分子构型为直线形
D. 可以发生加成反应,也能与氢氧化钠溶液反应
难度: 中等查看答案及解析
-
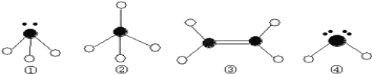
下列分子或离子的VSEPR模型为四面体且分子或离子空间构型为V形的是
A. NH4+ B. PH3 C. H3O+ D. OF2
难度: 中等查看答案及解析
-
用2个Cl取代甲醛分子中的H可得到碳酰氯,下列描述正确的是
A. 碳酰氯分子为平面三角形,分子中存在一个π键
B. 碳酰氯分子中的C原子为sp3杂化
C. 甲醛分子中的H-C-H键角与碳酰氯分子中的Cl-C-Cl相等
D. 甲醛分子中有4个σ键
难度: 中等查看答案及解析
-
下列分子或离子中,中心原子含有2对孤对电子的是
A. SO2 B. CH3- C. NH4+ D. H2S
难度: 中等查看答案及解析
-
下列说法中正确的是
A. AB3型的分子空间构型必为平面三角形
B. PCl3分子是三角锥形,这是因为磷原子是sp2杂化的结果
C. sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的4个sp3杂化轨道
D. 中心原子采取sp3杂化的分子,其几何构型可能是四面体形或三角锥形或V形
难度: 中等查看答案及解析
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
A. X与Y形成化合物时,X可以显负价,Y显正价
B. 第一电离能X一定大于Y
C. 在元素周期表中X可能位于Y的右面
D. Y的气态氢化物的稳定性小于X的气态氢化物的稳定性
难度: 中等查看答案及解析
-
2016年IUPAC将合成化学元素第115号(Mc)提名为化学新元素,Mc的原子核最外层电子数是5,下列说法不正确的
A. Mc位于第七周期
B. 中子数为173的Mc核素符号是
C. Mc与N元素属于同一主族
D. Mc的同位素原子具有相同的电子数
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. NH3和CH4的中心原子都是sp3杂化
B. 基态原子的核外电子排布为[Kr]4d105s1的元素属于d区
C. SO2和CO2都是直线形分子,其中心原子都是sp杂化
D. 电子由低能级跃迁至较高能级时,可通过光谱仪直接摄取原子的发射光谱
难度: 中等查看答案及解析
-
表示一个原子在第三个能层上有10个电子可以写成
A. 3s10 B. 3d10 C. 3s23p53d3 D. 3s23p63d2
难度: 中等查看答案及解析
-
已知[ZnCl4]2-中Zn2+的4s轨道和4p轨道形成sp3型杂化轨道,则[ZnCl4]2-的空间构型为
A. 直线形 B. 平面三角形 C. 正四面体形 D. 平面正方形
难度: 中等查看答案及解析
-
下列说法中,错误的是
A. 非金属元素可能形成离子化合物
B. 金属元素不可能形成共价化合物
C. 对双原子分子来说,键能越大,含有该键的分子越稳定
D. 成键原子间原子轨道重叠的越多,共价键越牢固
难度: 中等查看答案及解析
-
下列有关原子轨道的叙述中正确的是
A. 硫原子的2s轨道能量较3p轨道高
B. 能层n=4的原子轨道最多可容纳16个电子
C. 铯原子的2s与5s 轨道均为球形
D. p能级的原子轨道呈哑铃形,随着能层序数的增加,p能级原子轨道也在增多
难度: 中等查看答案及解析
-
下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. PCl3中P原子sp3杂化,为三角锥形
B. BCl3中B原子sp2杂化,为平面三角形
C. CS2中C原子sp杂化,为直线形
D. H2S分子中,S为sp杂化,为直线形
难度: 中等查看答案及解析
-
下列各组微粒的空间构型相同的是
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+ ④O3和SO2 ⑤CO2和C2H2 ⑥SiO44-和SO42-
A. ②⑤ B. ②③⑥ C. ①②③④ D. ③④⑤⑥
难度: 中等查看答案及解析
-
原子序数大于4的主族元素Xm+、Yn-的离子核外电子层结构相同,则关于X、Y两元素的叙述正确的是
A. X的原子序数小于Y的原子序数
B. X、Y的核电荷数之差是(m-n)
C. Y元素与X元素的族序数之差是8-(m+n)
D. X和Y处于同一周期
难度: 中等查看答案及解析
-
元素周期表中某区域的一些元素通常用来制造农药,这些元素是
A. 左下方区域的金属元素
B. 右上方区域的非金属元素
C. 稀有气体元素
D. 金属元素和非金属元素分界线附近的元素
难度: 中等查看答案及解析
-
关于元素周期表的下列叙述,错误的是
A. 元素周期表中,总共有16个纵行,每个纵行原子的外围电子排布相同
B. 在周期表中,把电子层数相同的元素排成一横行,称为一周期
C. 元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
D. 第VIIA族元素的原子随核电荷数的增加,得电子能力逐渐减弱
难度: 中等查看答案及解析
-
下列描述正确的是( )
A. ClO3-的空间构型为平面三角形
B. SiF4和SO32-的中心原子均为sp2杂化
C. C2H2分子中σ键与π键的数目比为1︰1
D. SF6中有6对相同的成键电子对
难度: 中等查看答案及解析
-
下列各组中的性质比较,正确的是
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 ③稳定性:HCl>H2S>PH3 ④还原性:I-> Br-> Cl-
A. ①②④ B. ③④ C. ①②③ D. ①②③④
难度: 中等查看答案及解析