-
下列说法正确的是
A. 可用裂化汽油萃取溴水中的溴单质
B. 棉、麻、蚕丝、羊毛完全燃烧,产物只有CO2和H2O
C. 门捷列夫将元素按原子序数由小到大的顺序依次排列,制出了第一张元素周期表
D. “司南之杓(勺),投之于地,其柢(勺柄)指南”,司南中的“杓”含Fe3O4
难度: 简单查看答案及解析
-
下列说法正确的是
A. 通过植物油的氧化反应可制人造奶油
B. 乙苯分子中所有碳原子一定在同一个平面上
C. 水或酸性KMnO4溶液可用来鉴别苯和乙醇
D. 分子式为C2H4与C4H8的有机物一定互为同系物
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA。下列说法正确的是
A. 标准状况下,11.2L12C18O中含有的中子数为8NA
B. 常温常压下,12g金刚石中含有C-C键数为4NA
C. 1mol Li2O、Na2O2的混合物中含有的离子总数大于3NA
D. 25℃时,pH=2的H2SO4溶液中含有H+的数目为0.02NA
难度: 中等查看答案及解析
-
利用下列实验装置能达到实验目的的是
A.
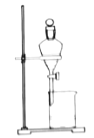 分离CH3COOH和CH3COOC2H5混合液
分离CH3COOH和CH3COOC2H5混合液B.
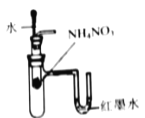 验证NH4NO3晶体溶于水的热效应
验证NH4NO3晶体溶于水的热效应C.
 蒸发FeCl3溶液得到FeCl3固体
蒸发FeCl3溶液得到FeCl3固体D.
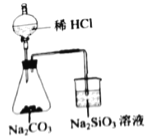 验证C、Cl、Si的非金属性强弱
验证C、Cl、Si的非金属性强弱难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期元素。X的氢化物常用于刻蚀玻璃,Y在同周期中金属性最强,Z的单质是人类将太阳能转化为电能的常用材料,W与X同主族。下列说法正确的是
A. 简单氢化物沸点:X>W
B. 简单离子半径:r(X)<r(Y)<r(W)
C. Z元素化学性质稳定,在自然界以游离态存在
D. W的简单离子会影响水的电离平衡
难度: 中等查看答案及解析
-
利用电化学原理可同时将SO2、CO2变废为宝,装置如图所示(电极均为惰性电极)。下列说法不正确的是

A. a为负极,发生氧化反应
B. 装置工作时,电子从c极流入b极
C. 若b极消耗16gO2,则Y中左侧溶液质量减轻16g
D. d电极反应式为CO2+6H++6e-=CH3OH+H2O
难度: 困难查看答案及解析
-
已知:pKa=-lgKa。25℃时,几种弱酸的pKa值如下表所示。下列说法正确的是
弱酸的化学式
CH3COOH
HCOOH
H2SO3
pKa
4.74
3.74
1.90 7.20
A. 向Na2SO3溶液中加入过量乙酸,反应生成SO2
B. 25℃时,pH=8的甲酸钠溶液中,c( HCOOH)=9.9×10-7mol·L-1
C. 25℃时,某乙酸溶液pH=a,则等浓度的甲酸pH=a-1
D. 相同温度下,等浓度的 HCOONa溶液比Na2SO3溶液的pH大
难度: 困难查看答案及解析
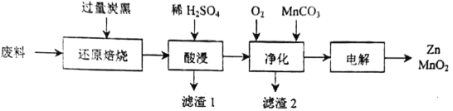
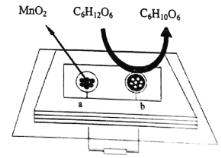
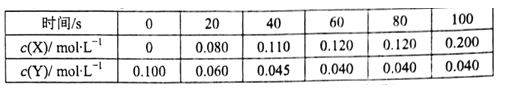
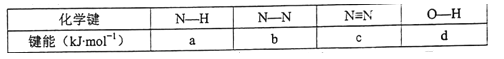
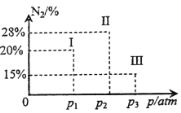
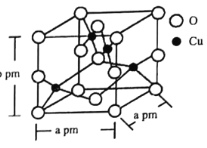
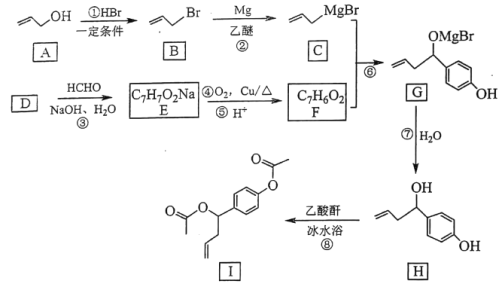
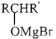
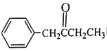 的合成路线(无机试剂任选)
的合成路线(无机试剂任选)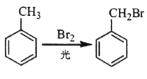 ____________
____________