-
化学与日常生活密切相关,以下说法正确的是
A.乙醇和汽油都是可再生资源,应大力推广“乙醇汽油”
B.可以用聚乙烯塑料作食品包装袋
C.食品加工、消毒防腐常使用福尔马林
D.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数,下列说法中正确的是
A.0.5 mol羟基中含有的电子数为5 NA
B.具有6.02×1023个中子的D2O的质量为4.0 g
C.C3H7O2N分子中含有氨基,0.1 mol该有机物含有共用电子对的数目为1.3 NA
D.0.1 mol·L-1的醋酸钠溶液中含有CH3COOH、CH3COO-粒子总数为0.1 NA
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.Fe(OH)2溶于足量氯水:Fe(OH)2 + 2H+= Fe2++ 2H2O
B.有机物A与足量NaOH溶液共热:

C.碳酸钠固体加入盐酸:Na2CO3 + 2H+= 2Na++ 2H2O + CO2↑
D.NaAlO2溶液与KHCO3溶液混合:AlO2-+ HCO3-+ H2O = Al(OH)3↓+ CO32-
难度: 中等查看答案及解析
-
下列推断正确的是
A.根据同浓度两元素含氧酸钠盐(正盐)溶液的碱性强弱,可判断其非金属性的强弱
B.根据同主族两非金属元素氢化物沸点高低,可判断其非金属性的强弱
C.根据相同条件下两主族金属单质与水反应的难易,可判断其金属性的强弱
D.根据两主族金属原子最外层电子数的多少,可判断其金属性的强弱
难度: 中等查看答案及解析
-
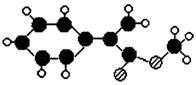
科学家曾合成具有独特结构的化合物1和2,发现化合物1加热后可得化合物2。以下关于化合物1和2的说法中正确的是
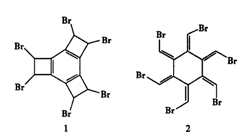
A.化合物1和2互为同分异构体
B.1 mol化合物2完全燃烧消耗O2 13.5 mol
(Br
HBr)
C.化合物1和2均属于芳香族化合物
D.化合物1中所有原子处于同一平面
难度: 中等查看答案及解析
-
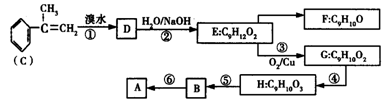
下列实验能达到预期目的的是
①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸;②用NaOH溶液除去苯中的少量苯酚;③用饱和NaHCO3溶液除去CO2中的少量SO2;④用加热的方法提取NH4Cl固体中混有的少量碘;⑤用酒精萃取碘水中的碘;⑥用米汤检验食用加碘盐中含碘;⑦用溴水鉴别直馏汽油与裂化汽油。
A.①⑤⑦ B.②③⑦ C.①②④⑤ D.②③⑤⑥
难度: 中等查看答案及解析
-
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列判断正确的是

A.X元素可能为Al
B.X元素可能为Si
C.反应①和②互为可逆反应
D.反应①和②一定为氧化还原反应
难度: 中等查看答案及解析
-
在体积固定为2 L的密闭容器中,A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化情况如图甲所示。下列有关说法不正确的是

A.该反应的化学方程式为4A + 5B
6C + 4D
B.前2 min用B表示的反应速率约为0.0021 mol·L-1·s-1
C.2 min时,外界条件的改变可能是升高温度或加入了催化剂
D.若起始时只加入A、B且物质的量分别为1.6 mol和2.0 mol,则达平衡时A、B的转化率不相等
难度: 中等查看答案及解析