-
NA代表阿伏加德罗常数,下列有关叙述正确的是
A.标准状况下,2.24LH2O含有的电子数等于NA
B.常温下,100mL1mol·L-1Na2CO3溶液中阴离子总数大于0.1NA
C.分子数为NA的N2、C2H4混合气体体积约为22.4L,质量为28g
D.3.4gNH3中含N—H键数目为0.2NA
难度: 简单查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染的绿色水处理剂。工业制高铁酸钠的方法有如下两种:
①湿法制备的主要反应方程式为:Fe(OH)3+ ClO—+ OH— → FeO42—+ Cl—+ H2O
②干法制备的主要反应方程式为: FeSO4+ Na2O2 → Na2FeO4+ Na2O+ Na2SO4 + O2↑
(均未配平)
下列有关说法不正确的是
A.高铁酸钠中铁显+6价
B.湿法制备的反应方程式中,氧化剂和还原剂的物质的量之比为3∶2
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的Fe(OH)3还能吸附水中的悬浮杂质
难度: 简单查看答案及解析
-
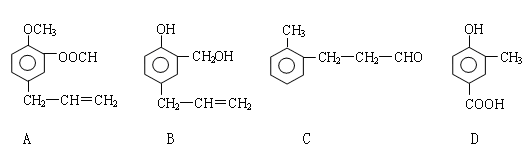
下列关于有机物的叙述正确的是
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.乙酸和乙酸乙酯互为同分异构体
C.油脂和纤维素都是能发生水解反应的高分子化合物
D.甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应
难度: 简单查看答案及解析
-
下表各组物质中,物质之间不可能实现如图所示转化的是
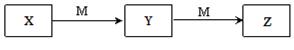
选项
X
Y
Z
M
①
Al3+
Al(OH)3
AlO2-
NaOH
②
AlO2-
Al(OH)3
Al3+
HCl
③
Fe
FeCl2
FeCl3
Cl2
④
Cl2
FeCl3
FeCl2
Fe
⑤
NaOH
Na2CO3
NaHCO3
CO2
⑥
NH3
NO
NO2
O2
⑦
C2H5OH
CH3CHO
CH3COOH
O2
⑧
H2S
SO2
SO3
O2
A.只有③ B.③④ C.④⑥⑧ D.②③⑦
难度: 简单查看答案及解析
-
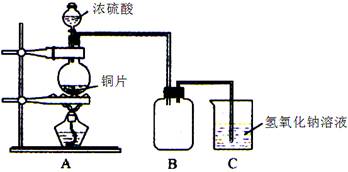
下列关于各装置图的叙述不正确的是
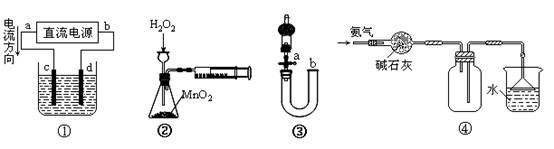
A.装置①中,c为阳极,d为阴极
B.装置②可定量测定H2O2的分解速率
C.关闭活塞a,从b处加水,可以检查装置③的气密性
D.装置④可用于收集并吸收多余的氨气
难度: 简单查看答案及解析
-
下图表示反应X(g)+4Y(g)
5Z(g);△H<0,在某温度时X的浓度随时间变化的曲线:
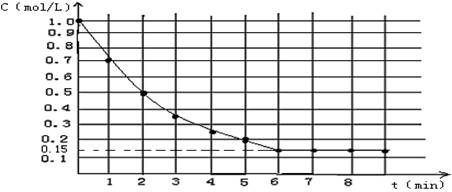
下列有关该反应的描述正确的是
A.若Z是有色气体,只压缩容器的体积,平衡不移动,则气体颜色不变。
B.若升高温度,则X的平衡转化率减小,υ(逆)增大,υ(正)减小
C.若X和Y的平衡转化率相等,则起始时X和Y的物质的量之比为1 :4
D.若平衡时X的转化率为85% ,则起始时Y的物质的量浓度为3.4 mol·L-1
难度: 简单查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果。下列图像描述正确的是
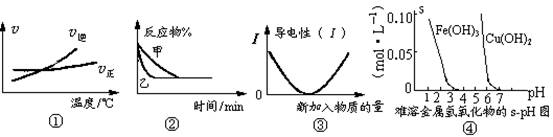
A.根据图①可判断可逆反应“A2(g)+3B2(g)
2AB3(g)”的ΔH>0
B.图②表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH=4左右
难度: 简单查看答案及解析