-
W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是
A. 原子半径大小为W<X<Y<Z
B. X的氢化物水溶液酸性强于Z的
C. Y2W2与ZW2均含有非极性共价键
D. 标准状况下W的单质状态与X的相同
难度: 中等查看答案及解析
-
人类在未来将逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法错误的是:
A. 煤、石油和天然气都属于碳素燃料
B. 发展太阳能经济有助于减缓温室效应
C. 太阳能电池可将太阳能直接转化为电能
D. 目前研究菠菜蛋白质“发电”不属于“太阳能文明”
难度: 简单查看答案及解析
-
下列物质在水溶液中的电离或水解方程式书写正确的是( )
A. CH3COO-+H2O = OH-+CH3COOH B. HF+H2O
H3O++F-
C. H3PO4
3H++PO
D. NaHCO3
Na++H++CO
难度: 中等查看答案及解析
-
参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )

A. 正反应为放热反应
B. 断键吸收的总能量大于成键放出的总能量
C. 反应物总能量高于生成物总能量
D. 升高温度可增大正反应速率,降低逆反应速率
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,124gP4中所含P—P键数目为4NA
B. 100mL1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
难度: 中等查看答案及解析
-
下列有关说法不正确的是( )
A. 其他条件一定时,平衡常数发生变化,化学平衡必定发生移动
B. 某特定反应的平衡常数仅是温度的函数
C. 通常情况下,一个放热且熵增的反应也有可能非自发进行
D. 反应NH3(g)+HCl(g) NH4Cl(s)在室温下可自发进行,则该反应的ΔH <0
难度: 中等查看答案及解析
-
下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. 向FeCl3溶液中加KSCN,有
Fe(SCN)3(血红色)+3KCl反应,平衡后向体系中加入KCl固体,使体系红色变浅
C. 装有
的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析
-
下列关于溶液酸碱性的说法中正确的是( )
A. pH=7的溶液一定显中性 B. 中性溶液中,c(H+)一定是1.0×10−7mol·L−1
C. c(H+)= c(OH−)的溶液显中性 D. 在100°C时,纯水的pH<7,因此显酸性
难度: 中等查看答案及解析
-
下列对氨水溶液中存在的电离平衡NH3·H2O
NH4++OH-叙述正确的是( )
A. 加水后,溶液中n(OH-)增大
B. 加入少量浓盐酸,溶液中c(OH-)增大
C. 加入少量浓NaOH溶液,电离平衡正向移动
D. 加入少量NH4Cl固体,溶液中c(NH4+)减少
难度: 中等查看答案及解析
-
在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是( )
A. 若降温,该反应的平衡常数减小
B. 吸收y mol H2只需1 mol MHx
C. 达到平衡后,容器内气体密度保持不变
D. 若向容器内通入少量氢气,则v(放氢)>v(吸氢)
难度: 中等查看答案及解析
-
硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下图,
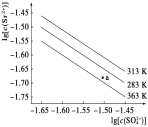
下列说法正确的是( )
A. 313K时,根据曲线计算可知Ksp(SrSO4) 数量级为10-5
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 283 K时,图中a点对应的溶液是饱和溶液
D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
难度: 困难查看答案及解析
-
在一定条件下,Na2CO3溶液中存在
+H2O
+OH-平衡。下列说法不正确的是( )
A. 加入NaOH固体,
减小
B. 通入CO2,溶液pH减小
C. 升高温度,平衡常数增大
D. 稀释溶液,
增大
难度: 中等查看答案及解析
-
反应4HCl(g)+O2(g)
2Cl2(g)+2H2O(g)中,4 mol HCl 被氧化,放出115.6 kJ的热量。
又知:
,
;
判断下列说法正确的是( )
A. 该反应的ΔH=+115.6 kJ·mol-1
B. 断开1 mol H—O 键与断开1 mol H—Cl 键所需能量相差约为32 kJ
C. HCl中H—Cl 键比H2O中H—O键稳定
D. 由题中所提供信息判断氯元素的非金属性比氧元素强
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是( )
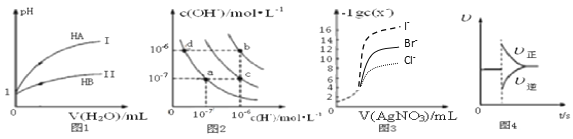
A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B. 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
D. 图4表示在N2(g)+3H2(g)
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
难度: 中等查看答案及解析
-
25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8, 0.1mol/L的NaHTeO3溶液中,下列粒子的物质的量浓度关系不正确的是( )
A. c(Na+)>c(HTeO3-)>c(OH-)>c(H2TeO3)>c(H+)
B. c(Na+)=c(TeO32-)+c(HTeO3-)+c(H2TeO3)
C. c(Na+)+c(H+)= c(HTeO3-)+2c(TeO32-)+c(OH-)
D. c(H+)+c(H2TeO3)= c(OH-)+c(TeO32-)
难度: 困难查看答案及解析
-
环辛四烯常用于制造合成纤维染料、药物,其结构简式如图所示。下列有关它的说法正确的是( )
A. 一氯代物有2种 B. 与苯乙烯、
互为同分异构体
C. 1mol该物质燃烧,最多可以消耗9molO2 D. 常温下为液态,易溶于水
难度: 中等查看答案及解析
-
在25℃时,固定容积的密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,建立平衡需要的时间为20 s,则下列说法不正确的是( )
物质
X
Y
Z
初始浓度/(mol·L-1)
0.2
0.1
0.1
平衡浓度/(mol·L-1)
0.05
0.05
0.2
A. 反应可表示为3X+Y
2Z
B. 建立平衡过程中,用Z表示的反应速率为v(Z)=0.005 mol·L-1·s-1
C. 达平衡后,X、Y浓度分别增加0.35 mol·L-1和0.15 mol·L-1,平衡正移,X的转化率变小
D. 若初始浓度:X为0.2 mol·L-1,Y为0.2 mol·L-1,Z为0.8mol·L-1,则v正>v逆
难度: 中等查看答案及解析
-
1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是( )
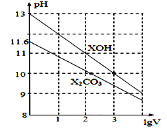
A. XOH是弱碱
B. pH=10的溶液中c(X+):XOH大于X2CO3
C. 已知CO32-的水解常数Kh1远远大于Kh2,则Kh1约为1.0×10-3.8
D. 当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且c(HCO3-)/c(CO32-)减小
难度: 困难查看答案及解析
-
下图为常温下向10mL0.1 mol·L-1 NH3·H2O中加入等浓度的盐酸时,NH3·H2O的物质的量随V(盐酸)的变化曲线。(电离度为已电离的NH3•H2O占初始时NH3•H2O的百分比),下列说法正确的是( )
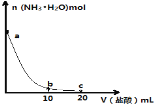
A. 测得a点时溶液的pH=11,则NH3·H2O的电离度为1%
B. b点时溶液的pH=7
C. 水的电离程度:b<c
D. c点时溶液中存在关系式:2c(Cl-)=c(NH4+) +c(NH3•H2O)
难度: 简单查看答案及解析
-
乙酸橙花酯是一种食用香料,其结构简式如图所示,关于该有机物叙述正确的是( )
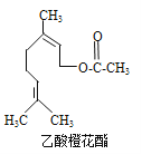
①分子式为C12H20O2
②能使酸性KMnO4溶液褪色
③能发生加成反应,但不能发生取代反应
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A. ①②③ B. ①②④⑤⑥ C. ①②⑤⑥ D. ①②⑤
难度: 中等查看答案及解析



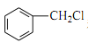 和丙醛合成
和丙醛合成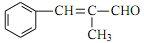 的流程图:__________________________(其他试剂任选)。
的流程图:__________________________(其他试剂任选)。