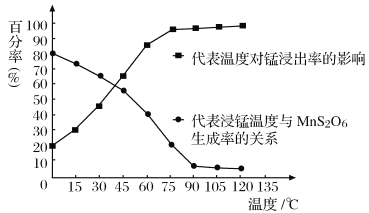
-
化学与科技、工业生产与生活均密切相关。下列有关叙述正确的是
A. 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化
B. 汉代烧制岀“明如镜、声如馨”的瓷器,其主要原料为石灰石
C. 二氧化硫是一种常见的漂白剂,常用于加工食品使食品增白
D. 铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝
难度: 简单查看答案及解析
-
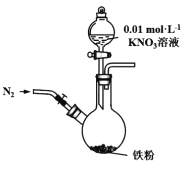
下列装置或操作能达到目的是
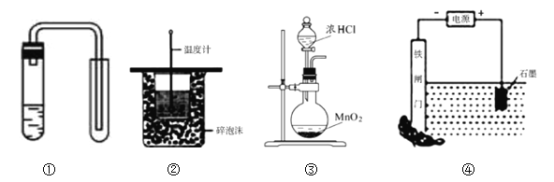
A. 装置①用铜与稀硝酸制取少量NO
B. 装置②可用于测定中和热
C. 利用装置③制取氯气
D. 装置④保护铁闸门不被腐蚀
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关说法正确的是
A. 235g核素
发生裂变反应:
+
+
+10
净产生的中子(
)数为10NA
B. 常温下,0.5L pH=14的Ba(OH)2溶液中OH-数目为NA
C. 一定条件下,32gSO2与足量O2反应,转移的电子数为NA
D. 标准状况下,5.6L乙烷中含有的极性键数目为1.5NA
难度: 中等查看答案及解析
-
短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,Y的氧化物是一种比较好的耐火材料,也是工业上冶炼Y的原料,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是
A. X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B. 电解X、Q元素组成的化合物的饱和溶液常被用于工业上制备X单质
C. W、X、Q三种元素都能形成多种氧化物
D. Y、Q形成的化合物是强电解质
难度: 中等查看答案及解析
-
有机物a和苯通过反应合成b的过程可表示为下图(无机小分子产物略去)。下列说法错误的是
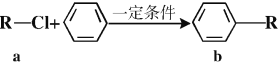
A. 该反应是取代反应
B. 若R为—CH3时,b中所有碳原子共面
C. 若R为—C4H9时,则b中苯环上的一氯代物可能的结构共有12种
D. 若R为—C4H5O时,1mol b最多可以与4molH2加成
难度: 中等查看答案及解析
-
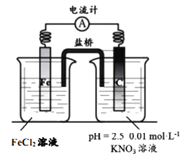
一种“全氢电池”的工作原理如图所示。下列说法不正确的是
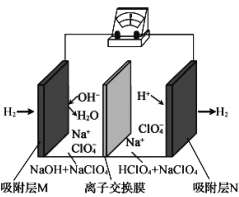
A. 电子流向是从吸附层M通过导线到吸附层N
B. Na+从左边穿过离子交换膜向右边移动
C. 离子交换膜可用质子交换膜
D. 负极的电极反应是:H2-2e-+2OH-=2H2O
难度: 中等查看答案及解析
-
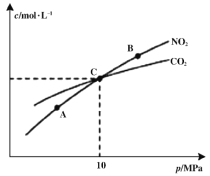
可逆反应①X(g)+2Y(g)
2Z(g) ②2M(g)
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
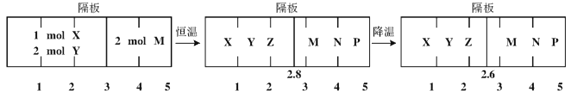
反应开始 平衡(I) 平衡(II)
下列判断正确的是
A. 达平衡(I)时体系的压强与反应开始时体系的压强之比为10:11
B. 反应①的正反应是吸热反应
C. 在平衡(I)和平衡(II)中,M的体积分数相等
D. 达平衡(I)时,X的转化率为50%
难度: 困难查看答案及解析