-
澳大利亚科学家发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6~9nm,在低于-183℃时,泡沫具有永久磁性。下列叙述正确的是
A. “碳纳米泡沫”能产生丁达尔现象
B. “碳纳米泡沫”与石墨互为同素异形体
C. “碳纳米泡沫”是一种新型的碳化合物
D. “碳纳米泡沫”和金刚石的性质相同
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法不正确的是
A. 只含0.1molNa2CO3的溶液中,所含阴离子总数大于0.1NA
B. 2g由H218O和2H2O组成的物质中含有的质子数为NA
C. 1mol CnH2n+2所含的共用电子对数为(3n+1)NA
D. 标准状况下,11.2LCl2溶于水,溶液中Cl2、Cl-、ClO-和HClO的微粒数之和为NA
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A. 元素Y的单质在常温下能与浓硝酸发生反应
B. 元素X与氢形成的原子比为1:1的化合物有很多种
C. 元素W、X的氯化物中,各原子均满足8电子的稳定结构
D. 元素Z可与元素X形成共价化合物XZ2
难度: 简单查看答案及解析
-
下列根据实验操作和实验现象所得出的结论正确的是
选项
实验操作
实验现象
结论
A
向淀粉-KI溶液中滴加氯水至过量
溶液先变蓝后褪色
I-先被氧化成I2,后I2可能被继续氧化成其他物质
B
向鸡蛋清溶液中滴加饱和Na2SO4溶液
有固体析出
Na2SO4能使蛋白质发生变性
C
向浓度均为0.1mol·L-1的NaCl和Na2SiO3溶液中分别滴加酚酞
NaCl溶液不变色,Na2SiO3溶液变成红色
非金属性:Si<Cl
D
将1mL0.1mol·L-1MgSO4溶液滴入10mL0.1mol·L-1NaOH溶液中,再滴加1mL0.1mol·L-1CuSO4溶液
先有白色沉淀生产,后变为浅蓝色沉淀
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
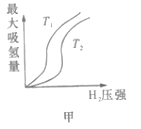
已知:CH4(g)+2H2S(g)
CS2(g)+4H2(g)。向恒容密闭容器中充入0.1molCH4和0.2molH2S,不断升高温度,测得平衡时体系中各物质的物质的量分数与温度的关系如图所示:
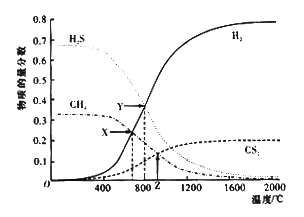
下列说法正确的是
A. 该反应的△H<0
B. 维持Z点温度,向容器中再充入CH4、H2S、CS2、H2各0.1mol时,v(正)>v(逆)
C. X点与Y点容器内压强比为51:55
D. X点CH4的转化率为20%
难度: 困难查看答案及解析
-
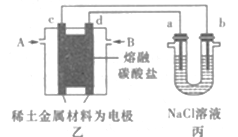
下图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。已知储氢装置的电流效率
 ×100%,下列说法不正确的是
×100%,下列说法不正确的是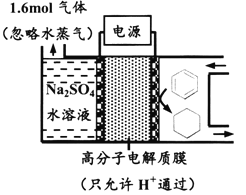
A. 采用多孔电极增大了接触面积,可降低电池能量损失
B. 过程中通过C-H键的断裂实现氢的储存
C. 生成目标产物的电极反应式为C6H6+6e-+6H+===C6H12
D. 若
=75%,则参加反应的苯为0.8mol
难度: 中等查看答案及解析
-
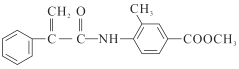
有机物Z是合成某药物的中间体,其合成“片段”如下所示:
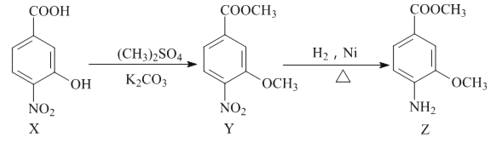
下列说法不正确的是
A. Y分子中一定有7个碳原子共平面
B. X、Y、Z分别与过量NaOH溶液反应,均生成2种产物
C. 与Z具有相同官能团的Z的同分异构体有10种
D. 有机物X能发生加成、取代、氧化反应
难度: 困难查看答案及解析
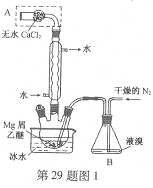
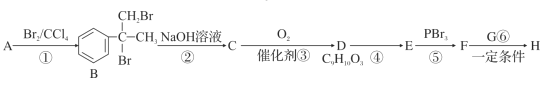
 )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示: