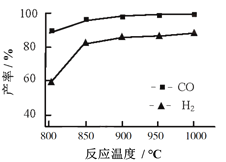
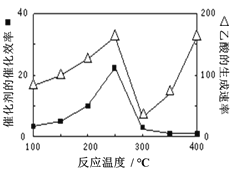
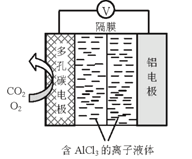
-
根据所给的信息和标志,判断下列说法不正确的是
A
B
C
D

此书记载,麻黄能“止咳逆上气”
碳酸氢钠药片


古代中国人已用麻黄治疗咳嗽
该药是抗酸药,服用时喝些醋能提高药效
看到有该标志的丢弃物,应远离并报警
贴有该标志的物品是可回收物
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列生活应用实例中,涉及氧化还原反应的是
A. 用白醋去除水垢
B. 用热的纯碱溶液清洗油污
C. 用风油精(含石蜡油)清洗透明胶残胶
D. 补铁剂(有效成分为Fe2+)与含维生素C共服效果更佳
难度: 简单查看答案及解析
-
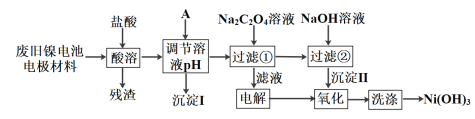
氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装
钢瓶
储运要求
远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪
泄漏处理
NaOH、NaHSO3溶液吸收
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
难度: 中等查看答案及解析
-
中国化学家研究的一种新型复合光催化剂[碳纳米点(CQDs)/氮化碳(C3N4)纳米复合物]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是
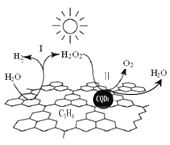
A. C3N4中C的化合价为 -4
B. 反应的两个阶段均为吸热过程
C. 阶段Ⅱ中,H2O2既是氧化剂,又是还原剂
D. 通过该反应,实现了化学能向太阳能的转化
难度: 中等查看答案及解析
-
下列“实验结论”与“实验操作及现象”相符合的一组是
选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+ 的氧化性强于Cu2+ 的氧化性
D
①某溶液中加入Ba(NO3)2溶液,产生白色沉淀
②再加足量盐酸仍有白色沉淀
原溶液中有SO42-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
2012年,国际纯粹与应用化学联合会(IUPAC)宣布第116号元素命名为鉝(Livermorium),元素符号是Lv。现有短周期主族元素X、Y、Z、W,原子序数依次增大,其中X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于IA族,W与X属于同一主族。下列说法正确的是
A. 116号元素与元素X、W原子最外层电子数相同
B. 由Y、Z两种元素组成的化合物是共价化合物
C. W的简单气态氢化物的热稳定性比Y的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 中等查看答案及解析
-
80℃时,1L 密闭容器中充入0.20 mol N2O4,发生反应N2O4
2NO2 △H = + Q kJ·mol﹣1(Q>0),获得如下数据:
时间/s
0
20
40
60
80
100
c(NO2)/mol·L﹣1
0.00
0.12
0.20
0.26
0.30
0.30
下列判断正确的是
A. 升高温度该反应的平衡常数K减小
B. 20~40s 内,v(N2O4)= 0.004 mol·L-1·s-1
C. 100s时再通入0.40 mol N2O4,达新平衡时N2O4的转化率增大
D. 反应达平衡时,吸收的热量为0.15Q kJ
难度: 中等查看答案及解析
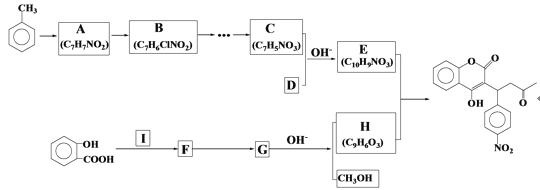
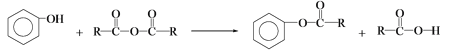
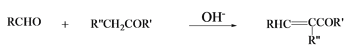
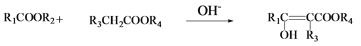
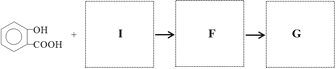
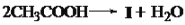 ,写出有关化合物的结构简式I ________F________G________。
,写出有关化合物的结构简式I ________F________G________。