-
某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制 0.5 mol·L-1 FeSO4 溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用____。该实验小组做如下实验。
| 实验序号 | 操作及现象 |
| ⅰ | 取 2 mL 上述 FeSO4 溶液于试管中,逐滴加入少量 0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
| ⅱ | 取 2 mL 上述 FeSO4 溶液于试管中,加入 2 滴 1 mol·L-1 KSCN 溶液无现象,通入一段时间 O2,溶液变为浅红色 |
| ⅲ | 重复实验ⅱ,向浅红色溶液中加入 5% H2O2 溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是 FeS。Na2S 溶液呈碱性,FeSO4 溶液与其反应不生成 Fe(OH)2而生成 FeS 的可能原因是_____。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:______、_____。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a.Fe3+ 被H2O2 还原 b.SCN- 被O2 氧化 c.SCN- 被H2O2 氧化
乙同学根据上述实验现象认为假设 b 不成立,他依据的现象是_____,甲同学利用上述部分试剂,通过以下实验验证了假设 c 成立。请将以下实验操作及现象补充完整。
| 步骤 | 试剂及操作 | 现 象 |
| i | 取褪色后溶液一份滴加 FeCl3 溶液 | ① ___ |
| ii | ② ___ | ③ ___ |
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置 A 接入下图所示的装置中,打开 K1 和 K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。C、D 中的溶液依次是 BaCl2 溶液和品红溶液,现象依次出现白色沉淀和品红褪色,写出硫酸亚铁高温分解反应的化学方程式________。
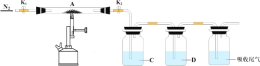
-
某化学兴趣小组对硫酸亚铁的一些性质进行探究。 回答下列问题:
(1)配制0.5 mol·L-1 FeSO4溶液时,将称量好的硫酸亚铁溶解于一定浓度的稀硫酸溶液中,结合化学用语解释稀硫酸的作用_____________________________。
该实验小组做如下实验。
| 实验序号 | 操作及现象 |
| ⅰ | 取2 mL上述FeSO4溶液于试管中,逐滴加入少量0.1 mol·L-1 Na2S 溶液,产生大量黑色沉淀 |
| ⅱ | 取2 mL上述FeSO4溶液于试管中,加入2滴1 mol·L-1 KSCN溶液无现象,通入一段时间O2,溶液变为浅红色 |
| ⅲ | 重复实验ⅱ,向浅红色溶液中加入5% H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
(2)进一步研究证实,黑色沉淀的主要成分是FeS。Na2S 溶液呈碱性,FeSO4溶液与其反应不生成Fe(OH) 2而生成FeS的可能原因是_____________________。
(3)用离子方程式表示步骤ⅱ中溶液变红的原因:___________、_____________。
(4)甲同学探究步骤ⅲ中溶液褪色的原因,提出如下假设:
a. Fe3+ 被H2O2还原 b. SCN- 被O2氧化 c. SCN- 被H2O2氧化
乙同学根据上述实验现象认为假设b不成立,他依据的现象是________________。
甲同学利用上述部分试剂,通过以下实验验证了假设c成立。请将以下实验操作及现象补充完整。
| 步骤 | 试剂及操作 | 现 象 |
| i | 取褪色后溶液一份滴加FeCl3溶液 | ①_________ |
| ii | ② _________________ | ③_________ |
(5)为探究硫酸亚铁的分解产物,将硫酸亚铁放入装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
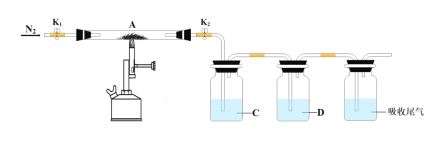
① C、D中的溶液依次是__________、________(填字母标号)。
a.品红溶液 b.NaOH溶液 c.BaCl2 溶液
d.Ba(NO3)2 溶液 e.浓H2SO4
② C、D中有气泡冒出,并可观察到的现象分别是____________ 、______________。
③ 写出硫酸亚铁高温分解反应的化学方程式______________________________。
-
绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
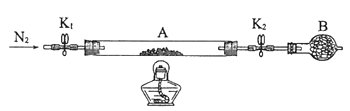
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式_____________________。
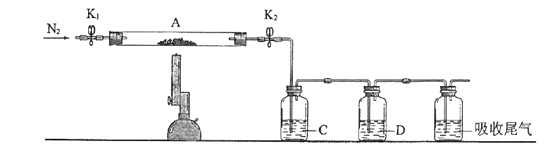
-
绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
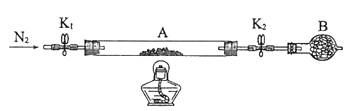
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式_____________________。
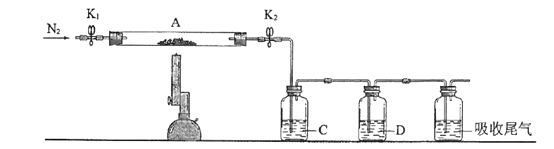
-
绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
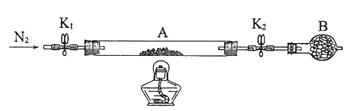
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式_____________________。
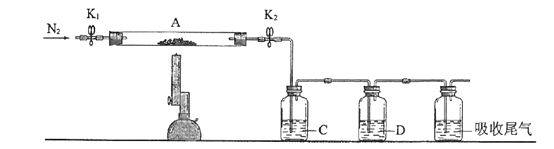
-
绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________;写出相关化学离子方程式:_____________、______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
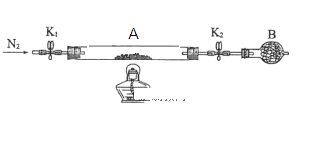
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
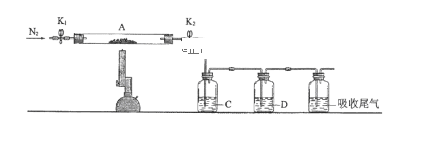
C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式:_________________________________ 。
-
绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·xH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x =________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”、“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
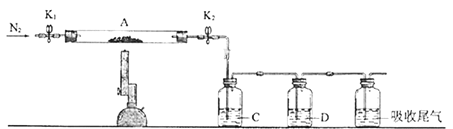
C、D中的溶液依次为BaCl2溶液、品红溶液。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式_________________。
-
绿矾化学式可以用FeSO4•xH2O表示,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______、____________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为mg。将样品装入石英玻璃管中,再次将装置A称重,记为ng。按下图连接好装置进行实验。
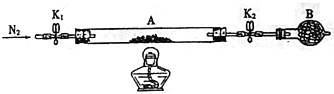
①将下列实验操作步骤正确排序_______(填标号);重复上述操作步骤,直至A恒重,记为Pg。
a.称量A b.关闭K1和K2 c.点燃酒精灯,加热 d.冷却至室温
e.打开K1和K2,缓缓通入N2 f.熄灭酒精灯
②根据实验记录,计算绿矾化学式中结晶水数目=__________(列式表示)。若实验时按c、e次序操作,则使x_____(填“偏大”“偏小”或“无影响”)。
(3)在蒸馏釜中隔绝空气煅烧绿矾,将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,蒸馏釜中剩余的固体为红棕色。绿矾油中溶质的化学式为______________。
(4)用下图装置模拟(3)中蒸馏釜中反应并检验产物,煅烧绿矾一段时间后,发现D中U 型管出现无色粘稠的液体,b中品红溶液褪色。
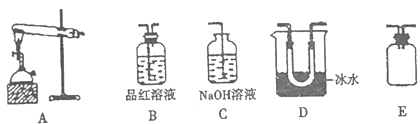
已知:三氧化硫的熔点为16.8℃,沸点为44.8℃
①A中提供热源的仪器名称:______,上述装置正确的连接顺序A→___________ (用大写字母表示)。
②写出煅烧绿矾的化学方程式_____________。
③实验过程中不宜加入过多绿矾,主要原因是_____________________。
-
绿矾(FeSO4·nH2O)在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。请回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化;再向试管中通入空气,溶液逐渐变红。请解释变红的原因________________________。
(2)为测定某绿矾中结晶水含量,按下图组装好仪器并检查气密性。将石英玻璃管(带两端开关K1和K2)(设整个为装置A)称重,记为80.120g。将样品装入石英玻璃管中,再次将装置A称重,记为 107.020g。按下图连接好装置进行实验。
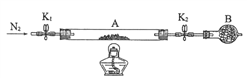
①仪器B的名称是____________________。
②实验操作步骤为: 第一步: 打开K1和K2,缓缓通入N2 ; 第二步:点燃酒精灯,小心加热;第三步:熄灭酒精灯 ;第四步:冷却到室温 ; 第五步:关闭K1和K2 ; 第六步:称量A 。 请问: 第一步缓缓通入N2 的目的是________________________。
重复上述操作步骤,直至A恒重,记为95.320g。
③计算绿矾化学式中结晶水n=________________(保留一位小数)。
(3)同学们查找资料可知,硫酸亚铁在高温下分解产物为Fe2O3 以及 SO2和SO3。为了验证硫酸亚铁分解的气体产物,将已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加强热充分反应后,管中残留固体为 _______ 色粉末。
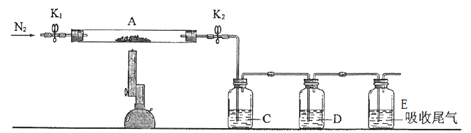
C、D中的溶液依次为________ 、________(填标号)。
a.品红 b.NaOH c.BaCl2 d.浓硫酸
(4)“严谨不仅仅是一种生活态度,更是科学精神”。检查装置气密性是化学实验中的重要操作之一,在上述32题实验装置气密性检查的操作是_______________________________。
-
(14分)
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
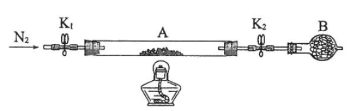
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
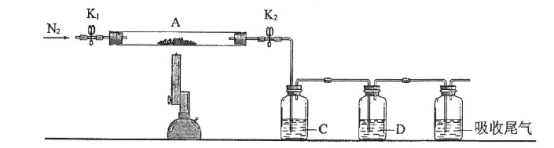
①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。

















