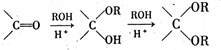
-
下列叙述不正确的是( )
A.严格说来,“通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收
B.生产生活中的“血液透析”、“制有色玻璃”、“熬粥”等都与胶体的知识有关
C.2010年诺贝尔化学奖授予“钯催化交叉偶联反应”的研究,采用钯催化可将碳原子连接在一起制造新的有机材料,钯在反应前后性质和质量均不变
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜要求难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,则下列说法正确的是( )
A.常温常压下,足量的Fe在1molCl2中充分燃烧,转移的电子数为2NA
B.在标准状况下,11.2LNO与11.2LO2混合后气体分子数为0.75NA
C.在标准状况下,22.4LHF气体中含有的分子数为NA
D.1molNa2O2与足量CO2充分反应转移的电子数为2NA难度: 中等查看答案及解析
-
曰常生活中所用的锌-锰干电池结构及成分如右图所示,对使用一段时间后的电池进行分析得其含有NH3、Mn23、ZnCl2、MnO2、NH4Cl、Zn、H2O等7种物质,根据以上信息,判断下列说法正确的是( )

A.普通锌-锰干电池中电解质溶液为NH4Cl、Mn02
B.放电时,NH4+向负极移动
C.石墨电极发生的反应为:2MnO2+2NH4++2e═Mn2O3+2NH3+H2O
D.用该电池电解一定浓度的CuSO4溶液,当产生11.2LH2时,溶解32.5gZn难度: 中等查看答案及解析
-
央视一台在2011年“3.15”晚会上,曝光了河南孟州、温县等地一些养猪场,采用违禁动物药品“瘦肉精”喂养生猪.如图是“痩肉精一盐酸克伦特罗”的结构,下列说法正确的是( )

A.分子中所有碳原子可能在一个平面内
B.化学式为C12H19CI3N2O,摩尔质量为313.5
C.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
D.1mol该化合物最多可以与5molNaOH反应难度: 中等查看答案及解析
-
下表评价合理的是 ( )
A.评价内容:向碳酸氢镁溶液中加入足量的氢氧化钠的离子方程式:Mg2++2HCO3-+2OH‑=MgCO3↓+2H2O+CO32
评价:正确
B.评价内容:SO2气体通入溴水,溴水褪色,说明SO2有漂白性
评价:错误,S02与溴水发生氧化还原反应,S02表现出还原性
C.评价内容:I‑,HCO3-,AlO2-、Fe2+、SCN_在溶液中能大量共存
评价:正确
D.评价内容:Cl2与含等物质的量FeBr2的溶液反应的离子方程式:2Fe2++2Br-+2Cl2═2Fe3++4C1-+Br2
评价:错误,Fe2+与Br_的物质的量之比为l:2难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.将pH=3的一元弱酸HA和pH=11的NaOH溶液混合后溶液显碱性,一定有:c(H+)<c(OH-)<c(A-)<c(Na+)
B.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2C03溶液、NaOH溶液:c(CH3COONa)>c(C6H5ONa)>c(Na2CO3)>c(NaOH)
C.在常温下,10mL0.02mol/LHCl溶液与10mL0.02mol/LBa(OH)2溶液充分混合,体积为20mL,则溶液的pH=12+lg2
D.将0.2mol/L的盐酸与0.1mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(AI3+)<c(H+)<c(Na+)<c(CI-)难度: 中等查看答案及解析
-
某温度、压强下,将一定量反应物通入密闭容器进行反应Si(s)+4HCl(g)⇌SiCl4(g)+2H2(g);△H=-QkJ/mol(Q>0),下列说法正确的是( )
A.使用过量的HCl或降低温度都可以提高Si的转化率
B.若反应开始时Si为1 mol,则达平衡时,放出热量为QkJ
C.若单位时间内生成xmolH2的同时,生成xmolHCl,则反应达到平衡状态
D.达到平衡后,若增大压强,则v正增大,v逆减小,平衡向正反应方向移动难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解铜19.2g(已知硝酸只被还原为NO气体);向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.下列分析或结果错误的是( )
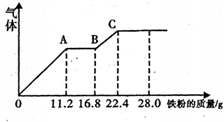
A.溶液中最终溶质为FeSO4
B.OA段产生是NO,AB段反应为2Fe3++Fe═3Fe2+,BC段产生氢气
C.混合液中N03-的物质的量为0.4mol
D.c(H2S04)为5mol•L-1难度: 中等查看答案及解析
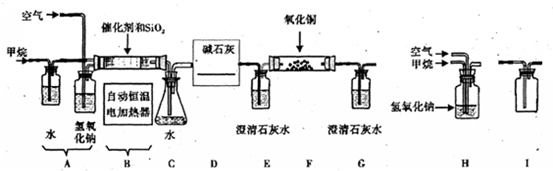
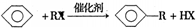
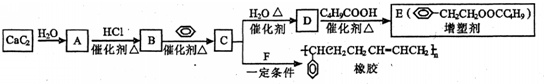
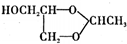 .已知:
.已知: