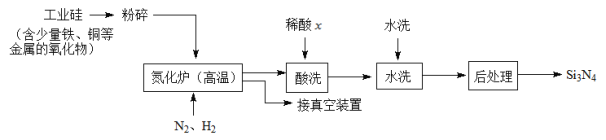
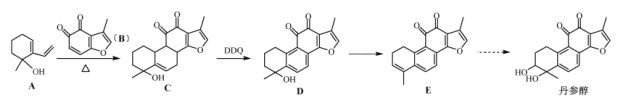
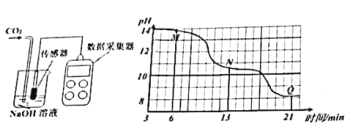
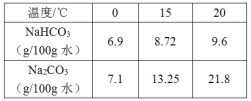
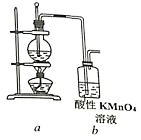
-
下列分离方法与物质的溶解度或溶解度变化无关的是( )
A. 萃取 B. 结晶 C. 蒸馏 D. 纸上层析
难度: 中等查看答案及解析
-
下列铝合金的性质与其用于国产C919飞机外壳无关的是( )
A. 导电性 B. 密度小 C. 抗腐蚀性强 D. 硬度大
难度: 简单查看答案及解析
-
、
、
中数字1、2、3表示( )
A. 中子数 B. 质量数 C. 核外电子数 D. 质子数
难度: 简单查看答案及解析
-
不能正确表述二氧化碳分子的是( )
A. 键角:180° B. 结构式:O=C=O
C. 比例模型:
D. 属于非极性分子
难度: 简单查看答案及解析
-
对NH3在工农业生产中用途的叙述错误的是( )
A. 制氨气 B. 制氮肥 C. 制硝酸 D. 做制冷剂
难度: 简单查看答案及解析
-
Fe与下列物质反应的产物,能使KSCN溶液显红色的是( )
A. H2O B. O2 C. S D. 足量稀HNO3
难度: 中等查看答案及解析
-
检验NH4+的方法是:向未知物中加强碱、加热,再用湿润的红色石蕊试纸检测气体产物,该检验过程中不涉及的反应是( )
A. NH4++OH-
NH3
+H2O B. NH3+H+→NH4+
C. NH3+H2O
NH3·H2O D. NH3·H2O
NH4++OH-
难度: 中等查看答案及解析
-
由一种原子直接构成的物质,不可能( )
A. 硬度很大 B. 常温下为气态 C. 属于原子晶体 D. 属于非电解质
难度: 简单查看答案及解析
-
能使Al(OH)3的电离平衡向碱式电离方向移动的是( )
A. HNO3 B. H2CO3 C. NaOH D. 氨水
难度: 中等查看答案及解析
-
在密闭容器内发生反应:3FeO(s)+H2O(g)
Fe3O4(s)+H2(g)-Q,H2O和H2物质的量随时间的变化如图所示。2min时仅改变一个条件,该改变的条件是( )
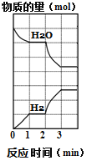
A. 减少c(H2O) B. 增加c(H2) C. 增大压强 D. 升高温度
难度: 中等查看答案及解析
-
在液溴和溴水的混合物中,对液溴描述正确的是( )
A. 深红棕色,在下层 B. 深红棕色,在上层
C. 紫黑色,在下层 D. 紫黑色,在上层
难度: 简单查看答案及解析
-
接触法制硫酸中能提高SO2转化率的条件是( )
A. 400~500℃ B. 常压 C. 催化剂 D. 过量的空气
难度: 中等查看答案及解析
-
不能说明氯元素的非金属性比硫元素强的是( )
A. 溶解性:HCl > H2S B. Cl2+H2S→2HCl+S
C. 稳定性: HCl > H2S D. 3Cl2+2Fe
2FeCl3、S+Fe
FeS
难度: 中等查看答案及解析
-
与漂粉精溶液的氧化性无关的现象是( )
A. 滴入酚酞试液先变红后褪色 B. 滴入AgNO3溶液有白色沉淀
C. 滴入浓HCl有黄绿色气体 D. 滴入FeCl2溶液有红褐色沉淀
难度: 中等查看答案及解析
-
不能鉴别黄色的溴水和碘水的物质是( )
A. CCl4 B. 淀粉溶液 C. 苯 D. NaOH溶液
难度: 中等查看答案及解析
-
反应①2H2O(l)
2H2(g)+O2(g)+Q1和反应②2H2O(l)
2H2(g)+O2(g)+Q2,都是分解得到H2和O2,下列判断错误的是( )
A. 反应①中太阳能转化为化学能 B. 反应②中电能转化为化学能
C. Q1>0、Q2<0 D. Q1=Q2
难度: 中等查看答案及解析
-
铜片和铁片(均少部分被氧化)一起放入足量的盐酸中充分反应。反应后的溶液中( )
A. 一定有Fe3+ B. 一定有Fe2+
C. 一定有Cu2+ D. 一定没有Cu2+
难度: 中等查看答案及解析
-
1mol H2和1mol I2置于恒温恒容密闭容器中发生反应:H2(g)+I2(g)
2HI(g)+9.4kJ,至t1时刻到达平衡状态,下列物理量与反应时间的关系不符合事实的是( )
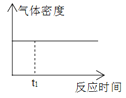
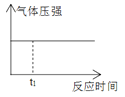
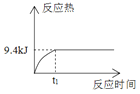
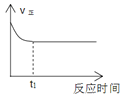
A
B
C
D
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
如下图所示
、
装置电解氯化铜溶液和饱和食盐水。下列判断错误的是( )
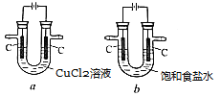
A. 阳极失电子的离子相同、产物相同
B. 阴极产物因得电子的离子不同而不同
C. 电解后两装置中溶液的pH都减小
D. 电解后只有
装置阴极的质量增加
难度: 中等查看答案及解析
-
pH=12的某溶液中有关数据如下:
离子
Na+
Ba2+
NO3-
Cl-
浓度(mol/L)
1.0×10
1.0×10
y
2.0×10
2.0×10
则
和y可能是( )
A. Fe2+;1.0×10
B. K+:1.0×10
C. SO42-:1.0×10
D. I-:2.0×10
难度: 中等查看答案及解析