-
下列说法错误的是
A. 减少烟花爆竹的燃放有利于保护环境
B. 四氯化碳和苯可作碘水中碘的萃取剂
C. 淀粉、蛋白质均能水解,且水解最终产物均为纯净物
D. 氯碱工业生产Cl2、NaOH溶液,使用的是阳离子交换膜
难度: 简单查看答案及解析
-
山道年蒿中提取出一种具有明显抗癌活性的有机物X,其结构简式如下图所示。下列有关说法错误的是
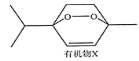
A. 该物质的分子式为C10H16O2
B. 该物质不可能所有的碳原子共平面
C. 该物质的一氯代物共有7种
D. 该物质能发生加成、取代、氧化、消去、还原等反应
难度: 中等查看答案及解析
-
下列实验操作、现象及得出的结论均正确的是
选项
实验操作
实验现象
实验结论
A
Cu片与足量浓硫酸加热反应,冷却后,再将冷水缓慢加入盛有反应混合物的烧杯中
溶液变蓝
证明反应生成了Cu2+
B
向添加KIO3的食盐中加入淀粉溶液、稀硫酸、KI溶液
溶液变蓝
氧化性:IO3->I2
C
向20.00 mL浓度均为0.1 mol/L的Na2CO3和Na2S的混合溶液中滴加几滴等浓度的AgNO3溶液
只产生黑色沉Ksp(Ag2S)
Ksp(Ag2S)> Ksp(Ag2CO3)
D
室温下,用pH试纸分别测定浓度均为 0.1mol/L的Na2SO3和NaHSO3两种溶液的pH
pH:Na2SO3>NaHSO3
HSO3-结合H+能力比SO32-的强
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、M的原子序数依次增加,X与Y不同周期,Z的内层电子数是其最外层电子数的5倍,惰性电极电解熔融ZM2可得到Z和M的单质。W的单质一般为淡黄色固体,易溶于YW2溶液。下列说法正确的是
A. W的氧化物的水化物溶于水均显酸性
B. 能用pH试纸测M单质的新制水溶液的pH
C. 原子半径:Y<W<M<Z
D. Z单质能与冷水迅速反应得到X单质
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol丙烯酸(CH2=CHCOOH)中含有的双键数目为0.1NA
B. 常温常压下,13.8gNO2与足量水反应,转移电子数为0.6NA
C. 7.8gNa2O2和Na2S的固体混合物中含有的离子总数为0.3NA
D. 含NA个CO32-的Na2CO3溶液中,Na+数目为2NA
难度: 中等查看答案及解析
-
我国科学家发明了一种安全可充电的柔性水系钠离子电池,可用生理盐水或细胞培养基为电解质,电池放电的总反应式为:Na0.44MnO2+NaTi2(PO4)3=Na0.44-xMnO2+Na1+xTi2(PO4)3,其工作原理如下图。
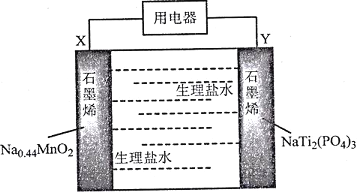
下列说法错误的是
A. 放电时,Cl-向X极移动
B. 该电池充电时Y极应该与电源的正极相连
C. 充电时,阴极反应为:NaTi2(PO4)3+xNa++xe-=Na1+ xTi2( PO4)3
D. 该电池可能作为可植入人体的电子医疗设备的电源
难度: 中等查看答案及解析
-
已知:常温下,Ksp(CuS)=1.0×10-36,K sp(HgS)=1.6×10-52;pM=-lgc(M2+)。常温下,向10.0mL0.20mol·L-1Cu(NO3)2溶液中逐滴滴加0.10mo l·L-1Na2S溶液,溶液中pM与加入Na2S溶液的体积(V)的关系如图所示。下列说法错误的是
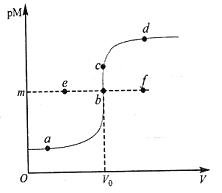
A. V0=20.0mL,m=18
B. 若c[Cu(NO3)2]=0.01mol·L-1,则反应终点可能为e点
C. a、b、d三点中,由水电离的c(H+)和c(OH-)的积最大的为b点
D. 相同条件下,若用等浓度等体积的Hg(NO3)2溶液代替上述Cu(NO3)2溶液,则反应终点b向c方向移动
难度: 中等查看答案及解析

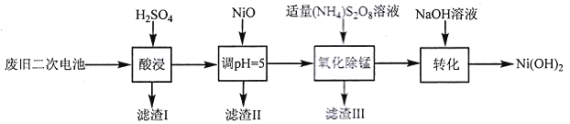


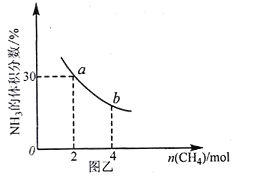
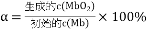 ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。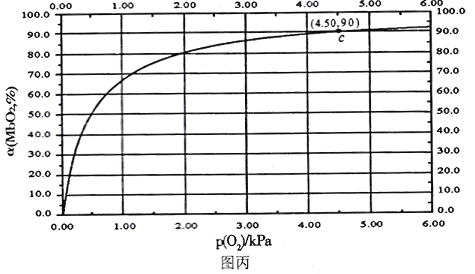
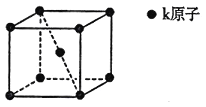
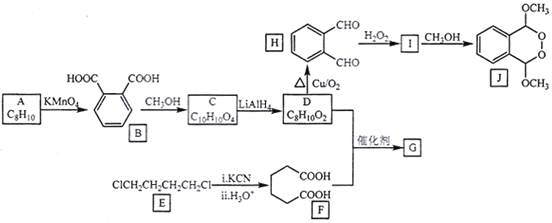
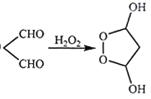
 为原料制备化合物
为原料制备化合物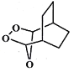 的合成路线(其他试剂任选)。____________________________________________________。
的合成路线(其他试剂任选)。____________________________________________________。